Главная
Resume
Список
публикаций
Изобретения
Статьи
Лекции
Полезная
информация
Врачебные
советы
|
|
Заболевания
пищевода, сопровождающиеся дисфагией
- Хирургическая
анатомия пищевода
- Дисфагия
- Патологическая
анатомия химического ожога пищевода
- Клиническая
картина химического ожога пищевода
- Лечение
химического ожога пищевода
- Классификация
рубцовых стриктур пищевода
- Клиническая
картина рубцовых стриктур пищевода
- Диагностика
рубцовых стриктур пищевода
- Лечение
рубцовых
стриктур пищевода
- Этиология
ахалазии
кардии
- Патогенез
ахалазии
кардии
- Классификация
ахалазии кардии
- Клиническая
картина ахалазии кардии
- Диагностика
ахалазии кардии
- Лечение
ахалазии
кардии
- Классификация
дивертикулов пищевода
- Клиника
дивертикулов пищевода
- Диагностика
дивертикулов пищевода
- Лечение
дивертикулов пищевода
- Статистика
и
эпидемиология рака пищевода
- Классификации
рака
пищевода
- Патологическая
анатомия рака пищевода
- Клиническая
картина рака пищевода
- Диагностика
рака
пищевода
- Лечение
рака
пищевода
ХИРУРГИЧЕСКАЯ
АНАТОМИЯ
ПИЩЕВОДА
 Пищевод
представляет собой полую мышечную,
выстланную изнутри слизистой оболочкой, трубку, соединяющую
глотку с желудком. Его функция заключается в продвижении пищи, при этом
он не
участвует в её переваривании и всасывании. Пищевод
представляет собой полую мышечную,
выстланную изнутри слизистой оболочкой, трубку, соединяющую
глотку с желудком. Его функция заключается в продвижении пищи, при этом
он не
участвует в её переваривании и всасывании.
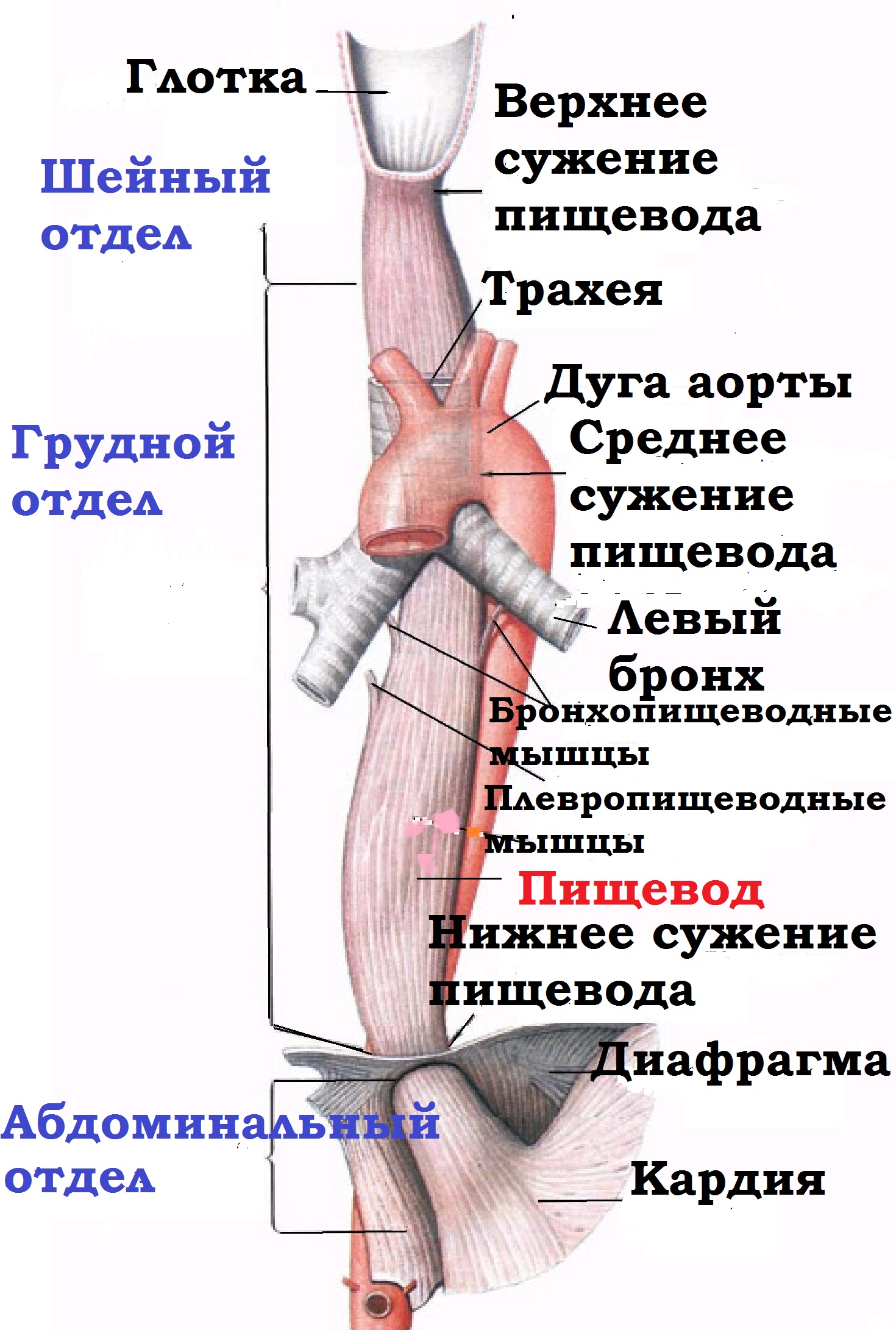
Пищевод сплющен спереди назад, располагается позади
трахеи и кпереди от позвонков. У взрослого место перехода глотки в
пищевод находится на уровне VI шейного позвонка на границе нижнего края
перстневидного хряща. Оканчивается он в месте перехода в желудок, на
уровне XI грудного позвонка. Длина его в среднем 25-30 см у
мужчин и 23-24 см у женщин и зависит от длины тела.
 Пищевод
по
своему ходу фиксирован к окружающим органам соединительными
тяжами, содержащими мышечные волокна и сосуды. Пищевод лежит не по
прямой линии, вначале он занимает срединное положение и тут же
направляется влево. Поэтому в шейном отделе он лежит левее средней
линии, несколько выступая из-под прикрывающей его трахеи. Пищевод
по
своему ходу фиксирован к окружающим органам соединительными
тяжами, содержащими мышечные волокна и сосуды. Пищевод лежит не по
прямой линии, вначале он занимает срединное положение и тут же
направляется влево. Поэтому в шейном отделе он лежит левее средней
линии, несколько выступая из-под прикрывающей его трахеи.
На
уровне
III-IV грудных позвонков пищевод оттесняется дугой
аорты и нисходящей аортой вправо и на уровне VII грудного позвонка он
уже полностью лежит справа от позвоночника. Затем пищевод отходит от
позвоночника вперед, отклоняясь влево и огибая аорту спереди.
Располагаясь левее и несколько кпереди от аорты, пищевод проходит через
пищеводное отверстие диафрагмы.
Пищевод имеет
четыре сужения:
а) перстневидно-глоточное, вызванное
действием нижнего сжимателя глотки и перстневидным хрящом и имеющее
размеры 23 мм в поперечнике и 17 мм по передне-заднему диаметру. Оно
является самым узким местом в пищеводе и расположено приблизительно на
уровне C VI
и названо Густавом Киллианом "ртом"
пищевода;
б) аортальное сужение находится в месте перекреста пищевода с
дугой аорты, соответственно которому на пищеводе имеется вдавление
стенки. Размеры этого сужения приблизительно 23 мм в поперечнике и 29
мм в передне-заднем измерении, располагается оно на уровне IV грудного
позвонка. Это сужение выявляется только в момент прохождения пищи
вследствие того, что дуга аорты мешает пищеводу расшириться. Частая
локализация рубцовых послеожоговых сужений пищевода, а также инородных
тел над этим сужением объясняется не столько сужением пищевода аортой,
сколько боковым изгибом пищевода
над
аортальным сужением;
в) бронхиальное сужение расположено
на месте перекреста пищевода с левым бронхом, где последний несколько
вдавливается в пищевод. Размеры этого сужения равны 25 мм в поперечнике
и 17 мм в передне-заднем измерении, располагается оно на уровне
V-VI грудного позвонка;
г) диафрагмальное сужение -
сегмент
пищевода в области прохождения через диафрагмальное кольцо.
Располагается на уровне X-XI грудного позвонка и по размерам
равно в диаметре 23 мм.
Большинство
авторов делят пищевод на три отдела:
1) шейный -
от
нижнего края перстневидного хряща на уровне VI шейного позвонка до
яремной вырезки на уровне I-II грудного позвонка. Длина его
равна
5-6 см;
2) грудной отдел от яремной вырезки до места
прохождения
пищевода через пищеводное отверстие диафрагмы на уровне X-XI
грудного позвонков, длина его 15-18 см;
3) брюшной отдел от
пищеводного отверстия диафрагмы до места перехода пищевода в желудок.
Длина его 1-3 см. В свою очередь грудной отдел пищевода
подразделяется на три части. Верхняя треть располагается на уровне
II-IV грудных позвонков и имеет длину около 5 см. Средняя
треть
лежит на уровне V-VII грудных позвонков, длина ее
5-7 см.
Нижняя треть пищевода располагается от верхнего края VIII грудного
позвонка до диафрагмы и имеет длину 6-7 см.
Кровоснабжение
пищевода.
Пищевод на разных
уровнях имеет различные источники
кровоснабжения.
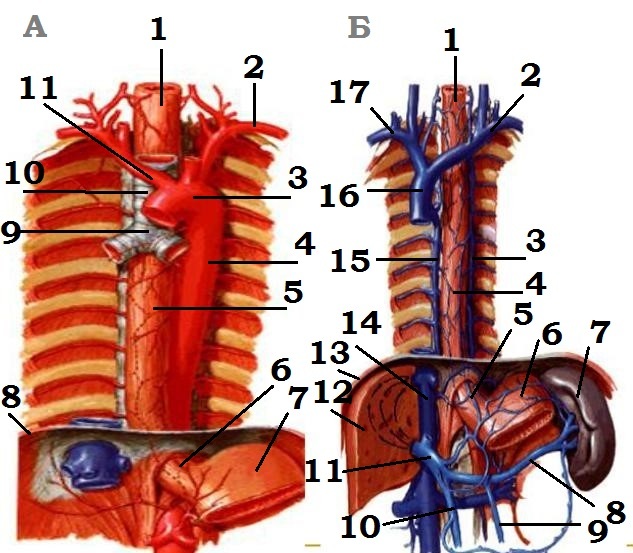
Кровоснабжение
пищевода.
А: 1 - шейный отдел пищевода; 2 - левая подкючичная артерия; 3 - дуга
аорты; 4 - восходящая аорта; 5 - грудной отдел пищевода; 6 -
абдоминальный отдел пищевода; 7 - дно желудка;
8 - диафрагма; 9 -
бифуркация трахеи; 10 - трахея; 11 - плече-головной ствол.
Б: 1 - шейный отдел
пищевода; 2 - левая
подключичная вена; 3 - полунепарная вена;
4 - грудной отдел
пищевода; 5 - абдоминальный отдел
пищевода; 6 - дно желудка; 7 -
селезёнка; 8 -
селезёночная вена; 9 - нижняя брыжеечная вена; 10 - верхняя брыжеечная
вена;
11 - воротная вена; 12 - печень; 13 - диафрагма; 14 - нижняя полая
вена; 15 - непарная вена;
16 - верхняя полая вена; 17 - правая
подключичная вена.
Шейный
отдел
получает кровь из трех источников, имеющих неодинаковое
значение.
1.
Ветви от
нижних щитовидных артерий, идущих по боковым поверхностям
пищевода и представляющим основной источник кровоснабжения. Справа
артерия более крупная.
2.
Тонкие ветви
от фарингиальных артерий, спускающиеся на заднюю
поверхность пищевода и заканчивающиеся на боковых поверхностях
пищевода.
3.
Непостоянные
ветви от подключичных артерий (артерии Люшка).
Грудной
отдел
пищевода имеет кровоснабжение из разных источников в
зависимости от уровня. Выше дуги аорты он снабжается кровью за счет
терминальных веточек артерий Люшка, а при их отсутствии и за счет
нижних веточек от нижней щитовидной артерии и восходящей ветви
бронхиальной артерии.
Среднегрудной
отдел пищевода снабжается в основном за счет бронхиальных
артерий, левая из которых отходит от задней поверхности восходящей
части дуги аорты, а правая от первой межреберной артерии. От этих
артерий отходят веточки, идущие в пищевод. Кроме этих артерий, иногда в
кровоснабжении пищевода участвуют артерии, отходящие от правой
полуокружности дуги аорты, собственно пищеводные артерии (обычно две
веточки), а в ряде случаев к пищеводу подходят веточки от правых
межреберных артерий.
Нижняя
часть
грудного отдела пищевода получает кровоснабжение за счет
пищеводных ветвей, отходящих непосредственно от нисходящей аорты и
иногда от межреберных артерий.
Кровоснабжение
брюшного отдела пищевода происходит в основном за счет
эзофаго-фундальных ветвей, идущих от левой желудочной и левой
нижнедиафрагмальной артерии. Эзофаго-фундальные ветви анастомозируют с
ветвями собственно пищеводных артерий, отходящих от дуги аорты. Иногда
к брюшному отделу пищевода идут веточки от селезеночной и верхней
надпочечниковой артерий.
Между
артериями
пищевода имеются множественные анастомозы. В верхнем
отделе пищевода наблюдаются анастомозы между пищеводными ветвями нижних
щитовидных и бронхиальных артерий. В средней части пищевода имеются
анастомозы между ветвями бронхиальных и собственно пищеводных артерий.
В нижнем отделе пищевода имеются анастомозы пищеводных артерий с
ветвями левой желудочной, а иногда с селезеночной и надпочечниковой
артериями. Достигнув стенки пищевода, артерии образуют две сосудистые
сети - на поверхности мышечного слоя из относительно крупных
артериальных стволов и в подслизистом слое - густую сеть
сосудов,
от которых мелкие ветви направляются в слизистую и мышечную оболочку,
где имеется хорошо развитая капиллярная сеть.
Из
капиллярного
русла кровь собирается в венулы, последние впадают в
вены, образующие венозное сплетение, расположенное в основном в
подслизистом слое - центральное подслизистое сплетение, где
основные стволы идут продольно. Центральное венозное сплетение
анастомозирует со второй поверхностной сетью пищевода, расположенной
параэзофагально и особенно выраженной в нижнем отделе
пищевода.
Отток из вен пищевода совершается по венам,
соответствующим питающим пищевод артериям. В шейном отделе через нижние
щитовидные, бронхиальные и самые верхние межреберные вены в безымянные
и верхнюю полую вены. Из среднего отдела по пищеводным и межреберным
ветвям в непарную и полунепарную вены и, следовательно, в верхнюю полую
вену. Из нижней трети пищевода венозная кровь через ветви левой
желудочной вены, верхние ветви селезеночной вены направляются в
портальную систему. Часть венозной крови из этого отдела пищевода
отводится левой нижней диафрагмальной веной в систему полой вены.
Лимфатическая
система пищевода образована
двумя группами лимфатических
сосудов — основной сети в подслизистом слое и сети в мышечном
слое, которая хотя относительно и независима, все же частично
соединяется с подслизистой сетью. В основной сети, в подслизистом слое,
лимфатические сосуды идут как в направлении ближайших регионарных
лимфатических узлов, прободая при этом мышечный слой, так и продольно
по ходу пищевода. При этом лимфоток в продольных лимфатических сосудах
в верхних 2/3 пищевода идет в направлении вверх, а в нижней трети
пищевода - вниз. Этим и
объясняется
метастазирование не только в ближайшие, но и в отдаленные
лимфатические узлы. При поражении верхних 2/3 пищевода
распространение опухолевых клеток идет далеко от опухоли
вверх, а
при поражении нижней 1/3 пищевода - вниз в перикардиальные по
ходу левой желудочной артерии и парааортальные лимфатические узлы. Из
мышечной же сети лимфоотток идет в ближайшие регионарные лимфатические
узлы. Регионарными лимфатическими узлами в верхнем отделе пищевода
являются лимфатические узлы, расположенные вдоль внутренних яремных вен
на шее, паратрахеальные лимфатические узлы - в верхнем
средостении, перибронхиальные и бифуркационные лимфатические узлы - в
среднегрудном отделе, периэзофагальные и в легочной
связке
- в нижнем средостении, поддиафрагмальные, перикардиальные и
по
ходу левой желудочной артерии и вдоль малой кривизны желудка - в
нижнем отделе пищевода. При блокировании путей обычного оттока
метастазы могут идти и в ретроградном направлении, что объясняется
ретроградным лимфооттоком в таких случаях.
Иннервация
пищевода происходит в
основном за счет блуждающих нервов,
а
также симпатических и соматических нервов, образующих крупнопетлистое
поверхностное сплетение, а также глубокие интрамуральные сплетения -
межмышечное ауэрбаховское и подслизистое мейснеровское. Эти
сплетения широко анастомозируют между собой. Шейный отдел пищевода
иннервируется в основном за счет возвратных нервов, отходящих от
блуждающих нервов. К тому же в глоточно-пищеводной части этого сегмента
в иннервации участвуют верхний гортанный нерв, шейный симпатический
ствол и наружный гортанный нерв. Поперечнополосатая мускулатура в этом
отделе иннервируется только за счет веточек возвратного нерва, по
которым проходят цереброспинальные периферические, нервные
волокна.
Грудной
ствол
пищевода иннервируется за счет ветвей возвратного нерва в
верхнем отделе, ветвей, отходящих от бронхиальных нервов и являющихся
ветвями блуждающего нерва, - в среднем отделе, и ветвями,
отходящими непосредственно от блуждающих нервов, - в лежащем
ниже
бронхов отделе. Симпатическая иннервация осуществляется за счет нижнего
шейного и нервного грудного узлов в верхнем отделе, грудной
симпатической цепочки и больших чревных нервов - в нижнем и
среднем отделах.
Блуждающие
нервы
в грудном отделе, рассыпаясь, образуют поверхностное
'(периэзофагеальное) сплетение, широко анастомозируют друг с другом,
раздваиваются, в них входят симпатические стволы и уже в нижнем отделе
пищевода фактически смешанные идут в виде стволов блуждающих нервов,
расположенных больше кзади - правого и кпереди -
левого.
При этом правый (задний) блуждающий нерв направляется к полулунному
ганглию и иннервирует, практически, весь пищеварительный тракт до
восходящей петли толстой кишки включительно. Левый (передний)
блуждающий нерв иннервирует в основном абдоминальный отдел пищевода и
дает веточки к желудку, иннервируя переднюю поверхность желудка, печень
и желчные пути.
Нервные
сплетения - внутримышечные и подслизистые -
состоят
из нервных клеток и сплетений, образующих нервную сеть, к которой
подходят волокна блуждающих и симпатических нервов, а от нервного
сплетения идут нервные волокна к нервным образованиям на слизистой
оболочке в виде чувствительных и двигательных окончаний -
палочковидных или овальных телец, расположенных под эпителиальным слоем
- сенсорные нервные образования. В мышечном сплетении волокна
заканчиваются фибриллярными пластинками, окружающими клетки сплетений и
мышечных волокон, где и заканчиваются контактом с ядрами клеток. Эти
нервные образования являются моторной иннервацией пищевода.
Пищевод
и, в
частности, его слизистая оболочка обладают тепловой,
болевой и тактильной чувствительностью. Самой чувствительной
зоной
пищевода является область перехода в желудок, эта область и подвержена
больше патологическим процессам.
ДИСФАГИЯ
 Дисфагия - общее
название
акта расстройств глотания. Дисфагия
пищевода
- затруднение продвижения пищевого комка или жидкости по
пищеводу. Дисфагия - общее
название
акта расстройств глотания. Дисфагия
пищевода
- затруднение продвижения пищевого комка или жидкости по
пищеводу.
Практически
любой вид дисфагии требует полного клинического обследования рта,
глотки, пищевода, кардии и желудка. Ряд экстра- и интраэзофагеальных
факторов способен вызвать извращение волевого рефлекса, нарушение
проходимости по глотке и пищеводу, неприятные ощущения или боли по ходу
пищевода при еде.
Внепищеводную дисфагию следует разделять на верхнюю, среднюю и нижнюю.
Верхнюю дисфагию вызывают заболевания щитовидной железы, лимфатических
узлов, мышц, позвоночника и других органов, а также многочисленные
центральные и периферические нарушения нервной регуляции функций рта,
глотки и устья пищевода. Мышечная дискоординация, парез или паралич
одной или нескольких мышц, участвующих в акте глотания, приводят к его
расстройству. Питание, особенно прием жидкой пищи, у таких больных
затруднено вследствие ее более легкого забрасывания в нос или
дыхательные пути. Глотание нарушается при гипофункции слюнных желез,
ксерозах или передозировке атропина и его производных. Такую нередко
болезненную дисфагию следует называть сухой. После отмены атропина
дисфагия и боли быстро исчезают.
Нередко дисфагия бывает у истерических личностей Иногда такая
психогенная дисфагия сопровождается истощением вследствие мнимого
страха перед едой. Эмоции, стрессовые моменты, еда всухомятку или
второпях и другие факторы могут вызвать даже у здорового человека
кратковременный приступ дисфагии (эпизодическая или функциональная
дисфагия), описываемой рентгенологами как валлекулярная дискинезия.
Верхняя дисфагия чаще становится вторичным проявлением основной болезни
и наблюдается в практике невропатологов, оториноларингологов,
психиатров, онкологов.
Средняя экстраэзофагеальная дисфагия обычно бывает косвенным симптомом
патологии органов заднего средостения (сосуды, нервы, лимфатические
узлы, сердце, плевра, соединительная ткань и др.). Расширение камер
сердца (до "бычьего сердца"), атриомегалия при
митральном
пороке, аномалии сердца, аорты, подключичной артерии, опухоли и кисты
перикарда, средостения обычно сопровождаются легкой дисфагией, а
злокачественные опухоли и метастазы делают дисфагию грозным
кардинальным признаком болезни.
Нижнюю экстраэзофагеалъпую дисфагию вызывают опухоли и кисты диафрагмы,
грыжи Бохдалека, гепатомегалия, спленомегалия и другие заболевания.
Аналогично деление внутрипищеводной дисфагии. К высокой
интраэзофагеальной дисфагии приводят спазмы устья пищевода
(фарингоэзофагеальная ахалазия), пограничные дивертикулы Ценкера,
инородные тела, острые и хронические воспаления слизистой оболочки рта,
глотки и гортани, ксерозы, синдром Пламмера-Винсона и др.
Дисфагия при тяжелых поражениях слизистой оболочки нередко бывает
настолько мучительной, что вызывает у больных условнорефлекторный страх
перед едой.
Средняя интраэзофагеальная дисфагия может быть вызвана как
функциональными нервно-мьшечными расстройствами, так и органическими
поражениями (эзофагиты, язвы, стриктуры, опухоли, дивертикулы и др.).
Дисфагия после приема любой пищи более характерна для эзофагита, после
жидкой - для функциональной патологии, после твердой - для
органического сужения просвета опухолью, стриктурой, стенозом. Низкая
дисфагия часто отражает халазию и ахалазию, грыжи пищеводного отверстия
диафрагмы, рефлюкс-эзофагиты, язвы, стриктуры, в том числе циркулярную
стриктуру пищевода, опухоли, транскардиальные смещения слизистой
оболочки, эпифренальные дивертикулы и др. Изредка (чаще при ахалазии,
реже при функциональной патологии, грыжах и опухолях) наблюдается
особый тип дисфагии с переменной непереносимостью горячей, холодной,
кислой, жирной, твердой или жидкой пищи.
Парадоксальная дисфагия, при которой твердая пища проходит лучше
жидкой, а большие куски пищи лучше малых, описывается в литературе как с-м Лихтенштерна.
Склеродермическая эзофагопатия сопровождается обычно усилением дисфагии
при горизонтальном положении тела, хотя этот симптом характерен и для
ахалазии, грыж, эзофагита, рака. Важно подчеркнуть, что дисфагия не
всегда указывает на раковый стеноз, однако она всегда должна вызывать
мысль об онкологическом заболевании.
Оценка
тяжести
дисфагии
| Степень
тяжести |
Характеристика |
| 0 |
Возможность
принимать обычную пищу |
| 1 |
Невозможность
принимать отдельные виды твердой пищи |
| 2 |
Употребление
только мягкой, полужидкой пищи |
| 3 |
Употребление
только жидкой пищи (свободное) |
| 4 |
Невозможность
проглотить обычное количество жидкой пищи |
ХИМИЧЕСКИЕ
ОЖОГИ
ПИЩЕВОДА И ИХ ПОСЛЕДСТВИЯ
 Химический ожог пищевода
развивается после
случайного или
преднамеренного приёма кислоты, щелочи или других агрессивных
жидкостей. Их первичное воздействие на слизистую оболочку
пищевода различно, что отражается на выраженности клинических
проявлений и тяжести последствий. Химический ожог пищевода
развивается после
случайного или
преднамеренного приёма кислоты, щелочи или других агрессивных
жидкостей. Их первичное воздействие на слизистую оболочку
пищевода различно, что отражается на выраженности клинических
проявлений и тяжести последствий.
 Глубина
поражения при ожогах
кислотами меньше, чем при ожогах щелочами.
Кислоты коагулируют белки клеток, нейтрализуя щелочи тканей. В
результате этих процессов образуется сухой струп (коагуляционный
некроз) на поверхности стенки пищевода, который препятствует
дальнейшему проникновению кислоты вглубь. Более слабое действие кислот
объясняется также быстрым понижением их концентрации из-за разведения в
воде отнятой у тканей. Вместе с ожогом пищевода концентрированные
кислоты чаще дают ожоги желудка. Последние являются более тяжелыми
инередко доминируют вразвитии клинической картины заболевания. Глубина
поражения при ожогах
кислотами меньше, чем при ожогах щелочами.
Кислоты коагулируют белки клеток, нейтрализуя щелочи тканей. В
результате этих процессов образуется сухой струп (коагуляционный
некроз) на поверхности стенки пищевода, который препятствует
дальнейшему проникновению кислоты вглубь. Более слабое действие кислот
объясняется также быстрым понижением их концентрации из-за разведения в
воде отнятой у тканей. Вместе с ожогом пищевода концентрированные
кислоты чаще дают ожоги желудка. Последние являются более тяжелыми
инередко доминируют вразвитии клинической картины заболевания.
 При
повреждении щелочами развивается мягкое омертвение тканей
пищеварительного тракта вследствие омыления жиров и разрушения белков (колликвационный
некроз).
Подвергшиеся контакту с щелочью ткани, теряют свою структуру,
разжижаются, представляют собой студенистую массу, почти не
препятствующую дальнейшему проникновению в глубину стенок пищевода
агрессивного вещества. Этим объясняется, что колликвационный некроз
тканей обширен и глубок, даже при приеме относительно небольших
количеств концентрированной щелочи. При
повреждении щелочами развивается мягкое омертвение тканей
пищеварительного тракта вследствие омыления жиров и разрушения белков (колликвационный
некроз).
Подвергшиеся контакту с щелочью ткани, теряют свою структуру,
разжижаются, представляют собой студенистую массу, почти не
препятствующую дальнейшему проникновению в глубину стенок пищевода
агрессивного вещества. Этим объясняется, что колликвационный некроз
тканей обширен и глубок, даже при приеме относительно небольших
количеств концентрированной щелочи.
Серьезные повреждения верхних отделов пищеварительного тракта могут
быть вызваны и приемом других веществ, например, пергидроля,
перманганата калия, которые являются сильными окислителями.
Относительно слабое обжигающее действие оказывают: медный
купорос, скипидар, марганцовокислый калий, настойка йода,
силикатный клей, нашатырный спирт, формалин, ацетон, перекись водорода
и др. В последнее время все чаще встречаются электрохимические ожоги
пищевода.
Патологическая
анатомия
Наиболее
выраженные изменения возникают в местах физиологических сужений - в
области надгортанника, глоточно-пищеводного сфинктера, на уровне
бифуркации трахеи, над физиологической кардией. В результате
химического ожога повреждается прежде всего слизистая оболочка полости
рта, глотки, пищевода, желудка. Вслед за гиперемией и отеком слизистой
оболочки быстро наступает некроз тканей. К концу 1-й недели начинается
отторжение некротизированных участков от подлежащих тканей и
образование поверхностных или глубоких изъязвлений. Поверхностные
изъязвления быстро эпителизируются (1-2 мес), глубокие заживают с
образованием грануляций и соединительной ткани. Заживление происходит
медленно, сморщивание соединительной ткани и формирование рубца
возможно в течение 2-6 мес. Это период хронического коррозивного
эзофагита. Рубцовые сужения пищевода образуются чаще в
нескольких
местах, в процесс сморщивания нередко вовлекается окружающая клетчатка.
Развиваются сращения и деформация пищевода. Рубцово-язвенный процесс в
пищеводе после химических ожогов может длиться годами. В результате
этого у отдельных больных рубцовые сужения пищевода возникают даже по
прошествии 10-20 лет с момента ожога.
Таким образом, при ожоге можно условно различать четыре стадии
патологоанатомических изменений:
I стадия - гиперемия и отек слизистой оболочки,
II стадия - некроз и изъязвления,
III стадия - образование грануляций,
IV стадия -рубцевание.
При химических ожогах пищевода принятое внутрь вещество оказывает,
помимо местного, и общетоксическое действие на организм, от которого в
первую очередь страдают сердце, печень, почки. Может развиться тяжелая
почечная недостаточность.
Классификация
ожога слизистой оболочки пищеварительного тракта по S.A. Zargar (1991)
при острых отравлениях агрессивными жидкостями
| Стадия
0 |
Норма |
| Стадия
I |
Отек
и гиперемия слизистой оболочки |
| Стадия
IIa |
Поверхностные
язвы, эрозии, рыхлость, пузыри, экссудат, геморрагии, белесые мембраны |
| Стадия
IIb |
Признаки
стадии IIa + глубокие одиночные или сливные изъязвления |
| Стадия
IIIa |
Небольшие
разбросанные участки множественных язв или поля некроза
коричневато-черного или серого цвета |
| Стадия
IIIb |
Протяженные
некрозы |
| Стадия
IV |
Перфорация |
Клиническая
картина химического ожога пищевода
 Клиническая
картина заболевания складывается из симптомов, обусловленных местным
действием химического вещества, и проявлений интоксикации. Тяжесть
поражения зависит главным образом от характера принятого вещества, его
концентрации, количества, степени наполнения желудка в момент
отравления, сроков оказания первой помощи. Локализация ожога и глубина
поражения зависит также от того, как больной пил агрессивную жидкость.
При приеме ее мелкими глотками возникает ожог слизистой оболочки
полости рта, надгортанника, верхней трети пищевода; если жидкость
выпивают "залпом", повреждается в основном нижняя треть пищевода и
желудок. Клиническая
картина заболевания складывается из симптомов, обусловленных местным
действием химического вещества, и проявлений интоксикации. Тяжесть
поражения зависит главным образом от характера принятого вещества, его
концентрации, количества, степени наполнения желудка в момент
отравления, сроков оказания первой помощи. Локализация ожога и глубина
поражения зависит также от того, как больной пил агрессивную жидкость.
При приеме ее мелкими глотками возникает ожог слизистой оболочки
полости рта, надгортанника, верхней трети пищевода; если жидкость
выпивают "залпом", повреждается в основном нижняя треть пищевода и
желудок.
Нарушение моторной функции пищевода и акта глотания при химических
ожогах обусловлено не только местными изменениями в пищеводе, но и
изменениями периферических вегетативных ганглиев и центральных нервных
структур, обеспечивающих акт глотания.
Условно выделяют четыре стадии клинических проявлений заболевания:
- I
стадия - острая токсикогенная стадия (первые 3-7 суток);
- II
стадия - стадия отторжения некротических масс или стадия "мнимого
благополучия" (1-3 неделя);
- III
стадия - стадия формирования послеожоговых рубцовых изменений (4-6
недель);
- IV
стадия - стадия
поздних осложнений (облитерация просвета, перфорация
стенки пищевода, развитие рака).
По
тяжести поражения в острой стадии выделяют три степени ожога
пищевода: легкую (первая), средней тяжести (вторая) и тяжелую (третья).
Первая степень ожога возникает в результате приема внутрь небольшого
количества едкого вещества в малой концентрации или горячей пищи. При
этом
повреждаются поверхностные слои эпителия на большем или меньшем участке
пищевода.
Вторая степень ожога характеризуется более обширными некрозами эпителия
на всю глубину слизистой оболочки.
Третья степень ожога - некроз захватывает слизистую оболочку,
подслизистый и мышечный слои,
распространяется на параэзофагеальную клетчатку и соседние органы.
Поражение пищевода кислотой или щелочью может сопровождаться поражением
желудка, двенадцатиперстной и начального отдела тощей кишки с
возникновением участков некроза и перфорацией их, что ведет к развитию перитонита
в остром периоде,
а также к
рубцовым деформациям желудка впоследствии.
 В I (острую)
стадию заболевания больные испытывают
тяжелые страдания. Вслед за приемом едкой щелочи или кислоты появляются
сильные боли в полости рта, глотке, за грудиной, в эпигастральной
области, обильное слюноотделение, многократная рвота, дисфагия
вследствие спазма пищевода в области ожога и отека слизистой оболочки.
Глотание невозможно. Больные возбуждены, испуганы.
Кожные покровы бледные, влажные. Дыхание учащено, имеется тахикардия.
Отмечают
различной степени явления шока: возбуждение или заторможенность,
вялость, плохая реакция на окружающую обстановку, сонливость,
акроцианоз, тахикардия, снижение артериального давления, глухие тоны
сердца, уменьшение количества мочи вплоть до анурии. Через несколько
часов после ожога наряду с симптомами шока появляются симптомы ожоговой
токсемии: повышение температуры тела до 39°, заторможенность
сменяется возбуждением, иногда возникают бред, мышечные подергивания.
Дыхание частое, поверхностное, частота пульса до 120-130
в минуту, артериальное давление снижено вследствие гиповолемии. У
больных
появляется мучительная жажда в результате дегидратации,
дизэлектролитемии. При исследовании крови отмечают лейкоцитоз, сдвиг
лейкоцитарной формулы влево, увеличение СОЭ, повышение гематокрита,
гипо- и диспротеинемию. В тяжелых случаях наблюдается гиперкалиемия,
гипохлоремия и гипонатриемия, метаболический ацидоз. В I (острую)
стадию заболевания больные испытывают
тяжелые страдания. Вслед за приемом едкой щелочи или кислоты появляются
сильные боли в полости рта, глотке, за грудиной, в эпигастральной
области, обильное слюноотделение, многократная рвота, дисфагия
вследствие спазма пищевода в области ожога и отека слизистой оболочки.
Глотание невозможно. Больные возбуждены, испуганы.
Кожные покровы бледные, влажные. Дыхание учащено, имеется тахикардия.
Отмечают
различной степени явления шока: возбуждение или заторможенность,
вялость, плохая реакция на окружающую обстановку, сонливость,
акроцианоз, тахикардия, снижение артериального давления, глухие тоны
сердца, уменьшение количества мочи вплоть до анурии. Через несколько
часов после ожога наряду с симптомами шока появляются симптомы ожоговой
токсемии: повышение температуры тела до 39°, заторможенность
сменяется возбуждением, иногда возникают бред, мышечные подергивания.
Дыхание частое, поверхностное, частота пульса до 120-130
в минуту, артериальное давление снижено вследствие гиповолемии. У
больных
появляется мучительная жажда в результате дегидратации,
дизэлектролитемии. При исследовании крови отмечают лейкоцитоз, сдвиг
лейкоцитарной формулы влево, увеличение СОЭ, повышение гематокрита,
гипо- и диспротеинемию. В тяжелых случаях наблюдается гиперкалиемия,
гипохлоремия и гипонатриемия, метаболический ацидоз.
При сопутствующем ожоге гортани и голосовых связок могут быть осиплость
голоса, затрудненное дыхание, асфиксия. В тяжелых случаях развивается
токсическое поражение паренхиматозных органов (острая
печеночная
и почечная недостаточность). Отравление уксусной эссенцией
может
вызвать развитие
внутрисосудистого гемолиза. У больных появляется желтуха, моча
приобретает цвет мясных помоев, отмечается билирубинемия,
гемоглобинурия, нарастает
анемия. В результате аспирации у больных может развиться трахеобронхит,
пневмония. При прямом повреждении сосудов в области ожога возникают
ранние кровотечения. Иногда на 5-7-й день развивается психоз
(психическая травма, стресс, боль, ожоговая токсемия).
II стадия. К концу 1-й недели начинается отторжение некротизированных
тканей пищевода. Проглатывание жидкой пищи становится несколько
свободнее, возможны кровотечения.
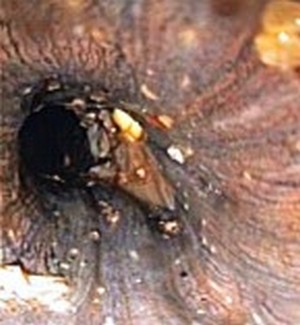
Ожог пищевода IIIb
ст. по S.A.
Zargar.
При глубоких некрозах возможна перфорация пищевода с развитием
симптомов медиастинита,
перикардита, эмпиемы
плевры,
пищеводно-бронхиального свища. Наличие последнего характеризуется
усилением болей за грудиной и в спине,
нарастанием одышки и тахикардии, температура тела приобретает
гектический
характер, ознобы сменяются проливными потами, возможно образование
подкожной эмфиземы, появление кашля при приеме жидкой пищи.
Аспирация,
возникшая в остром периоде, может проявляться симптомами
острого
трахеобронхита, пневмонии, абсцесса
легкого.
В тяжелых случаях при наличии обширных раневых
поверхностей на стенках пищевода возможно развитие сепсиса.
Латентный период характеризуется нарушением функции паренхиматозных
органов, что обусловлено дистрофическими изменениями, белковым
голоданием.
К концу месяца (стадия образования стриктуры) под влиянием лечения
обожженные участки пищевода заживают. У 10-15 % больных при
рентгенологическом
исследовании обнаруживают отсутствие продольной складчатости слизистой
оболочки, одиночные или множественные участки сужений пищевода
различной протяженности. У 20 % больных к концу месяца явления
"перемежающейся" дисфагии увеличиваются. При эзофагоскопии отмечают
различной протяженности участки, заживление которых происходит вяло.
Раневые поверхности покрыты плотным струпом, легко кровоточат.
Формирование рубца возможно в течение последующих нескольких месяцев. В
отдаленные сроки (до 2-3 лет) после ожога (стадия поздних осложнений)
на первое место в клиническом течении выступает дисфагия. От голодания
состояние больного прогресивно ухудшается. Помимо стриктур, возможно
развитие рака, перфорации стенки пищевода и таких осложнений, как
пневмония, абсцесс легкого, бронхоэктазы, дивертикулы,
пищеводно-бронхиальные свищи.
Лечение
химического ожога пищевода
Если
времени до оказания первой помощи или самопомощи прошло немного, то все
мероприятия должны быть направлены на тщательное удаление и
нейтрализацию агрессивного вещества из полости рта, глотки, пищевода и
желудка, причём осуществляться должны в строго определённой
последовательности.
Поражённого,
если есть возможность, помещают под водопроводный кран и достаточно
сильной струёй воды ему обмывают кожу вокруг рта, тщательно
прополаскивают и высушивают полость рта. Только после этого с помощью
толстого зонда смазанного растительным маслом пострадавшему промывают
пищевод и желудок холодной водой. Промывание желудка через зонд
наиболее эффективно, безопасно и не имеет противопоказаний в первые 6 ч
после приема агрессивного вещества, в дальнейшем эффективность
значительно снижается в связи с завершением его резорбции, а по
прошествии 12 ч промывание желудка неэффективно. Промывание
желудка без использования зонда с искусственным вызыванием рвоты
является крайне опасным, поскольку повторное прохождение агрессивного
вещества по пищеводу усиливает степень его ожога. Кроме того, при этом
существует опасность аспирации агрессивного вещества и развития ожога
дыхательных путей. Внутрь
дают взбитые яичные белки, крахмал, слизистые
отвары, молоко, растительное
масло.
Рекомендуется глотать кусочки льда, на живот кладут
пузырь со льдом.
Слабительные
и рвотные средства
противопоказаны. Применение раствора натрия гидрокарбоната (пищевой
соды) с целью нейтрализации кислот недопустимо, так как вызывает острое
расширение желудка образующимся углекислым газом и усиление
кровотечения. В качестве нейтрализующего средства может служить окись
магния (жженая магнезия) в виде водной взвеси 10-20 г. порошка в 2 л.
воды или Алгелдрат+Магния гидроксид внутрь с последующим промыванием
желудка.
Для снятия боли больным показано введение наркотиков (промедол, морфин
и др.). Для уменьшения саливации и снятия спазма пищевода вводят
атропин, спазмолитики. Целесообразно назначение
антигистаминных препаратов (димедрол, супрастин, дипразин и др.).
В стационаре больным проводят противошоковую и дезинтоксикационную
терапию.
Для нормализации деятельности сердечно-сосудистой системы назначают
сердечные гликозиды, кортикостероиды. Коррекцию метаболического ацидоза
осуществляют путем введения 5% раствора бикарбоната натрия. Для борьбы
с гиповолемией проводят парентеральное питание больных в течение 3-4
дней. Для профилактики вторичной инфекции и пневмонии назначают
антибиотики широкого спектра действия.
С целью предупреждения развития рубцового сужения пищевода больным с
1-х суток дают через каждые 30-40 мин по 1-2 глотка микстуры,
содержащей подсолнечное масло, анестезин, 5% раствор новокаина,
антибиотик, с 3-го дня их кормят охлажденной пищей. Ранний прием
микстуры и пищи как бы осуществляет "мягкое" бужирование пищевода.
Формированию рубцов препятствует также назначение кортикостероидов,
которые задерживают развитие
фибробластов и уменьшают воспалительные изменения в пищеводе. В
настоящее время признано целесообразным проведение раннего (с 9-11-го
дня) бужирования пищевода в течение 1-1,5 мес в сочетании с подкожным
введением лидазы или ронидазы в течение 2 нед. Слишком раннее, раньше
этого срока начатое бужирование дает противоположный эффект, вызывая
обострение воспалительного процесса в пищеводе и усиление рубцевания.
Перед началом бужирования необходимо произвести эзофагоскопию, которая
позволит установить степень ожога, отсутствие неотторгнувшихся
некротических тканей.
Бужирование пищевода небезопасно и может осложниться его перфорацией с
развитием гнойного медиастинита
и плеврита,
поэтому его следует проводить
с большой осторожностью.
Для профилактики рубцовых стенозов пищевода применяется гипербарическая
оксигенация (ГБО), которая уменьшает глубину зоны некроза,
отграничивает лейкоцитарную инфильтрацию, способствует очищению раневой
поверхности и вызывает эпителизацию ее к концу 1-го месяца. ГБО
подавляет образование соединительной ткани, что приводит к развитию
более рыхлого, тонкого и эластического рубца пищевода. При
возникновении ранних кровотечений проводят гемостатическую терапию.
При отравлении уксусной эссенцией и развитии внутрисосудистого гемолиза
необходимо применение ощелачивающей терапии (5 % раствор бикарбоната
натрия) и форсированного диуреза.
При развитии острой почечной недостаточности показано проведение
гемодиализа.
При поражении гортани и развитии асфиксии больным накладывают
трахеостому. При перфорации пищевода необходимо срочное хирургическое
вмешательство.
В течение всего острого периода заболевания нужен тщательный уход за
полостью рта. Для контроля за изменениями в пищеводе периодически
проводят эзофагоскопию.
Рубцовые стриктуры
пищевода после
химического ожога
Рубцовые
сужения (стриктуры) пищевода образуются у 70-80 % больных, перенесших
его химический ожог. Наиболее часто они локализуются в местах
физиологических сужений пищевода.
Классификация
рубцовых
стриктур пищевода
Рубцовые
стриктуры пищевода могут быть одиночными и множественными, полными
(проходимость пищевода отсутствует) и неполными (сохраняется некоторый
просвет пищевода), высокими (глоточные, шейные,
бифуркационные) и
низкими (эпифренальные и абдоминальной части пищевода),
расположенными по оси пищевода или эксцентрично. По протяженности
различают пленчатые стриктуры, представляющие собой тонкие
мембраны шириной до 0,5 см, кольцевидные протяженностью 2-3 см
и
трубчатые длиной более 3 см.
Эндоскопическая классификация рубцовых стенозов пищевода (Ю.И.
Галлингер и соавт. 2000) предполагает четыре степени сужения:
I степень - диаметр пищевода в зоне сужения составляет 9-11 мм (через
стриктуру проходит среднекалиберный гастроинтестинальный эндоскоп);
II степень - просвет пищевода в зоне сужения составляет 6-8 мм
(проходит бронхофиброскоп диаметром 5,5-7 мм);
III степень - диаметр пищевода в зоне сужения составляет 3-5 мм
(проходит ультратонкий эндоскоп диаметром 2,4-2,8 мм, а если он не
применяется, то просвет сужения оценивается по диаметру струны или
катетера);
IV степень - просвет сужения составляет 1-2 мм или вовсе отсутствует
(ниже зоны сужения удается провести только направляющую струну, за
исключением случаев полной облитерации).
Клиническая
картина рубцовых
стриктур
пищевода
Ведущим
симптомом рубцовой стриктуры является дисфагия, которая появляется на
3-4-й неделе после химического ожога. Вначале она слабо выражена, но с
течением времени становится мучительной. Иногда дисфагия
сопровождается чувством тяжести, болью за грудиной. При выраженной
длительно протекающей рубцовой стриктуре пища застаивается в пищеводе,
приводя к его супрастенотическому расширению, и подвергается там
разложению. Это усугубляет течение эзофагита, способствует развитию
периэзофагита, приводит к появлению изжоги, отрыжки,
гиперсаливации. Из-за ограничения приема пищи больные
значительно
теряют в массе.
 Боли
за грудиной, усиливающиеся при прохождении пищевого комка, встречаются
при
обострении эзофагита. Рвота не является специфическим признаком
рубцовой стриктуры пищевода, более характерно срыгивание, возникающее
сразу после приёма пищи. Боли
за грудиной, усиливающиеся при прохождении пищевого комка, встречаются
при
обострении эзофагита. Рвота не является специфическим признаком
рубцовой стриктуры пищевода, более характерно срыгивание, возникающее
сразу после приёма пищи.
Течение
рубцовой стриктуры нередко осложняется внезапной обтурацией пищевода
пищевым комком, частыми хроническими заболеваниями легких и плевры,
укорочением пищевода с формированием скользящей грыжи
пищеводного
отверстия диафрагмы, дивертикулов
пищевода,
пищеводно-респираторных свищей, перфорацией пищевода во время еды или
эзофагоскопии, малигнизацией.
Диагностика рубцовых
стриктур
пищевода
Наличие
рубцовой стриктуры подтверждается во время
рентгеноконтрастного
исследования пищевода и фиброэзофагоскопии.
К
рентгенологическим признакам сужения пищевода относятся:
- сужение
просвета пищевода тубулярной формы с отсутствием в этой
области
рельефа слизистой оболочки и перистальтики (с-м карандаша);
- нахождение
выше рубцовой стриктуры супрастенотического расширения конической или
мешотчатой формы без изъеденности, зазубренности краев.
Рентгенограммы двух
пациентов с
ожогами пищевода:
а – рентгенограмма первого пациента в левой косой проекции.
Картина эзофагита. В просвете умеренно расширенного пищевода много
слизи; б – рентгенограмма пищевода в левой косой проекции
другого
больного. Циркулярное сужение пищевода протяженностью около 7 см на
уровне VII грудного позвонка (красная стрелка) и супрастенотическое
расширение над ним (синяя стрелка).
Фиброэзофагоскопия позволяет
уточнить состояние зева, глотки, расположение входа в рубцовую
стриктуру, степень супрастенотического расширения, характер воспаления,
протяженность рубцовой стриктуры, взять биопсию для
исключения
рака.
.
Эндоскопическая
картина рубцовой
стриктуры пищевода.
Во
время рентгенологического и эндоскопического исследований
обязательно оценивается состояние желудка.
Лечение
рубцовых стриктур пищевода
Больным
с послеожоговой стриктурой пищевода проводится бужирование рубцового
стеноза или пластика пищевода.
Бужирование является основным методом лечения при рубцовой стриктуре
пищевода.
При формирующемся сужении пищевода может быть использована тактика раннего профилактического бужирования. Его проводят в
стационаре 3 раза в неделю методом бужирования по струне-проводнику с
переходом на прямое бужирование. При сформировавшихся стриктурах
пищевода, вызывающих нарушение проходимости и не обеспечивающих
нормальное питание, рекомендуется проводить поддерживающее бужирование
пищевода, которое выполняется через 1,5-2 месяца после получения
ожога. Для
бужирования используются термопластические или силиконовые бужи
различного диаметра: конической формы, с оливой
на конце, полых рентгеноконтрастных. Чаще применяются бужи конической
формы № 1-40, диаметр которых в сантиметрах равен частному от деления
номера бужа на коэффициент 1/3.
Известно несколько методов бужирования:
1) вслепую через рот (слепое бужирование);
2) за нить;
3) полыми рентгеноконтрастными бужами по металлической
струне-проводнику.
При бужировании пищевода вслепую через рот за 20-30 мин до начала
процедуры назначается премедикация: подкожно вводятся 1 мл 0,1 %
раствора атропина сульфата и 1 мл 1 % раствора димедрола. Больной
усаживается на стул со спинкой, а врач располагается впереди него. Для
расширения пищевода используются бужи, предварительно помещенные в
горячую воду, что придает им эластичность. Затем, исходя из данных
эзофагоскопии, а также рентгеноконтрастного исследования пищевода о
диаметре сужения, берется буж соответствующего номера. Он смазывается
вазелином и на высоте глотательных движений плавно без особого усилия
вводится в пищевод в области рубцовой стриктуры. Длительность
нахождения бужа в пищеводе составляет 15-30 мин. Во время одного сеанса
проводят не более двух номеров бужа. Последующее бужирование начинают с
бужа, которым закончилось предыдущее, или на один номер меньше.
Недостатком данного способа бужирования является достаточно частое
развитие перфорации пищевода.

Слепое бужирование.
Бужирование
полыми рентгеноконтрастными бужами осуществляется по
металлической струне-проводнику. В случае легкого прохождения
бужа
в
пищевод проводится буж следующего номера.
А: металлическая
струна-проводник.
Б: буж без струны и со струной-проводником.
Бужирование пищевода за нить предполагает
предварительное наложение гастростомы. Через 5-7 дней с момента
операции больной заглатывает длинную капроновую (лавсановую) нить с
металлический бусинкой на конце и выпивает 0,5-1 л жидкости. После
снятия зажима с трубки, ранее проведенной через гастростому в желудок,
бусинка с нитью выходит наружу. Таким образом, один конец нити
находится на уровне ротовой полости, второй - выведен через
гастростому. Посредством привязывания к концам нити бужа и его тракции
производится бужирование рубцовой стриктуры: ретроградно или антеградно.
В
настоящее время наиболее распространенным способом гастростомии
для бужирования являются методы Топровера и Кадера, а также
лапароскопическая
гастростомия.
Гастростомия
по Топроверу.
Бужирование
пищевода помимо перфорации может осложниться пищеводным
кровотечением, острым эзофагитом. Поэтому одновременно с бужированием
больной получает комплексное общее и местное лечение, направленное на
профилактику эзофагита, кровотечений, образование нежного эластического
рубца в зоне стриктуры. В этих целях проводят лазерное облучение
пищевода, введение в его слизистую в зоне сужения лидазы и т. д.
Помимо традиционных методов бужирования при рубцовом сужении пищевода
находят применение вибрационный способ бужирования, а также
эндоскопические вмешательства: баллонная пневмо(гидро)дилатация
стриктуры, электрорассечение стриктуры, временное эндопротезирование
пищевода.
Вибрационный способ бужирования заключается в проведении в зону сужения
по струне под контролем фиброгастроскопа только концевой части бужа.
Проксимальный конец бужа соединяется с поперечным вибратором.
Растяжение рубцовой стриктуры достигается за счет вибрации с частотой
колебаний 50 Гц. Длительность сеанса составляет 8-10 мин. В отличие от
традиционного метода бужирования создаваемая в зоне сужения вибрация
помимо механического растяжения усиливает лимфо- и кровообращение,
повышает регенераторные процессы в тканях, предупреждая развитие
рубцовых сращений.
Эффективность бужирования зависит от многих факторов, в том числе
большую роль играет протяженность стриктуры. Так, при
коротких стриктурах (не более 5 см) стойкого выздоровления
удается
добиться у 85-90 % больных, особенно хороший эффект
наблюдается
при применении эндоскопической баллонной пневмо(гидро)дилатации.
Она выполняется специальными дилататорами
- баллонами длиной 4-10 см, диаметром 0,6-3 см (катетеры типа Edex -
Puestow и т. д.) или термопластическими дилататорами типа Savary -
Gilliard и т. д., которые проводятся через стриктуры по
струне–направителю или под контролем рентгеновского экрана.
Продолжительность сеанса дилатации составляет 3-5 мин, а интервал
выполнения - 2-3 дня. Следует иметь в виду, что по достижении
проходимости пищевода выполняется профилактическая дилатация 1 раз в
10-14 дней в течение нескольких месяцев.
Конструкция
баллонного гидростатического дилататора.
Электрорассечение используется в лечении больных с ригидными рубцовыми
стриктурами. Данный метод предполагает надсечение рубцового кольца в
3-4 радиальных направлениях с помощью игольчатого электрода или
папиллотома.
Временное эндопротезирование пищевода является способом закрепления
эффекта баллонной дилатации и электрорассечения рубцового сужения.
Сущность способа заключается во введении в просвет пищевода под
контролем фиброгастроскопа различных стендов - эндопротезов (трубки из
силиконовой резины импрегнированные силиконовым маслом, металлические
саморасширяющиеся стенды и др.). Продолжительность
эндопротезирования составляет недели и годы.
Пищеводный
биодеградабельный стент
SX-ELLA (ELLA-CS, Ltd).
Следует отметить, что пациентам с формирующимися после химического
ожога рубцовыми
стриктурами стентирование пищевода не рекомендуется в виду отсутствия
положительных результатов его применения на настоящее время.
Стентирование может сопровождаться такими осложнениями, как
грануляционный стеноз, стриктура выше и/или ниже стента, обтурация
пищевыми массами, отслойка его внутреннего покрытия с перекрытием
просвета, фрагментация и миграция стента, врастание протеза в стенку
пищевода с последующим некрозом, образование пролежней и свищей при
длительном стентировании, небезопасность удаления.
Хирургическое лечение при рубцовой стриктуре пищевода показано в
следующих случаях:
1) невозможность выполнения бужирования ввиду полной облитерации
просвета пищевода;
2) неудачные попытки проведения бужа через рубцовую стриктуру;
3) протяженная одиночная и короткие множественные рубцовые стриктуры;
4) множественный дивертикулез (псевдодивертикулез) пищевода;
5) быстрый рецидив рубцовой стриктуры;
6) повторная перфорация пищевода при бужировании;
7) наличие пищеводно-бронхиальных свищей;
8) малигнизация ожоговой стриктуры.
Наиболее частое противопоказание к операции - истощение больного.
В качестве предоперационной подготовки при полной рубцовой стриктуре
накладывается гастростома для энтерального питания больных. Цель
операции заключается в одноэтапной, а у ослабленных больных
многоэтапной пластике пищевода. Хирургическое вмешательство выполняется
не ранее чем через два года после ожога. В роли пластических материалов
выступают желудок, тонкий или толстый кишечник, кожа. Известно
множество методов выполнения пластики пищевода. Трансплантаты
проводятся впередигрудинно или внутригрудинно (ретростернально,
внутриплеврально, заднемедиастинально).
Тонкокишечная пластика пищевода по Ру (1906) заключалась в том, что из
начального отдела тонкой кишки формировался трансплантат, который
проводился через подкожный тоннель до яремной вырезки. При этом
отводящий конец кишки анастомозировался с желудком. Питание больного
осуществлялось через зонд, проведенный в верхний конец трансплантата, в
последующем выделялся шейный отдел пищевода, он пересекался и
накладывался эзофагоэнтероанастомоз.
П. А. Герцен (1907) усовершенствовал методику Ру, стал выполнять эту
операцию в три этапа. На первом этапе мобилизованную тонкую кишку
проводили не впередиободочно, а через брыжейку поперечной ободочной
кишки и желудочно-ободочную связку, что позволяло помещать трансплантат
в подкожном тоннеле до середины шеи. На втором этапе пересекали в
дистальном сегменте мобилизованную кишку и накладывали
гастроэнтероанастомоз. Третий этап заключался в выделении шейного
отдела пищевода, пересечении его и наложении эзофагоэнтероанастомоза.
При выполнении тонкокишечной пластики пищевода по С. С. Юдину (1941)
больному накладывается гастростома и производится мобилизация тощей
кишки (отступив 8-10 см от связки Трейтца) с пересечением ее и
наложением энтероанастомоза "конец в бок". Мобилизованная кишка
проводится впереди поперечной ободочной и располагается антеторакально
в подкожном тоннеле. Через 6-15 дней накладывается анастомоз кишки с
пищеводом конец в бок. При недостаточной длине трансплантата
формируется эзофагогастростома и еюностома, которые в последующем
соединяются посредством кожной трубки.
Толстокишечная пластика пищевода применяется, если требуется создать
трансплантат большой длины. При этом может быть использована правая или
левая ее половина, располагать которую можно изо- и
антиперистальтически.
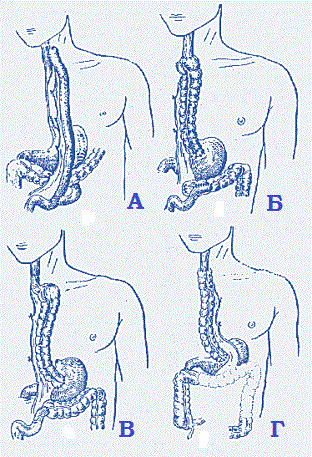
Варианты
тонко- и толстокишечных пластик пищевода.
1. Схема операции С. С. Юдина. 2. Схема операции
Ройта. 3. Схема операции по Лафаргу, Дюфуру, Кабанье и Шавана. 4. Схема
операции Ореонн и Туне.
В последние десятилетия наибольшее распространение получил способ
пластики пищевода изоперистальтической трубкой из большой кривизны
желудка (А. Ф. Черноусов с соавт., 1980). Операция характеризуется
сравнительно малой травматичностыо, меньшим числом опасных осложнений,
быстрым восстановлением приема пищи через рот, низкой летальностью.
Пластика пищевода
изоперистальтической трубкой из большой кривизны желудка.
А: формирование
искусственного пищевода
из большой кривизны желудка.
Б: изоперистальтическая трубка с питанием
за счет правой желудочно-сальниковой артерии.
Следует помнить, что желудок нельзя использовать для эзофагопластики
при его
ожоге, а также при наличии язвы двенадцатиперстной кишки.
Объем эзофагопластики определяется протяженностью рубцового поражения
пищевода. Так, у лиц с распространенными стриктурами выполняется
тотальная пластика пищевода. При сужении нижнего отдела пищевода и
кардии (сегментарная стриктура) производится частичная пластика
пищевода - резекция пораженного участка с замещением его
трансплантатом. Допустимо формирование обходного пищеводно-желудочного
анастомоза. В случае поражения глотки, шейного или шейно-грудного
отдела пищевода может применяться проксимальная сегментарная пластика
пищевода трансплантатом тонкой или толстой кишки.
АХАЛАЗИЯ
КАРДИИ
 Ахалазия кардии (от греч. a - отсутствие,
chalasis - расслабление) - это идиопатическое нервно-мышечное
заболевание, проявляющееся функциональным нарушением проходимости
кардии вследствие дискоординации между глотком, рефлекторным раскрытием
нижнего пищеводного сфинктера, двигательной и тонической активностью
гладкой мускулатуры пищевода. Ахалазию кардии считают редким
заболеванием: ее распространенность составляет по разным данным от 10
до 15,7 случая на 100 000 населения, а заболеваемость - 1,07-2,2 на 100
000 в год среди взрослого населения и 0,18 на 100 000 среди детей и
подростков до 16 лет. Ахалазия кардии (от греч. a - отсутствие,
chalasis - расслабление) - это идиопатическое нервно-мышечное
заболевание, проявляющееся функциональным нарушением проходимости
кардии вследствие дискоординации между глотком, рефлекторным раскрытием
нижнего пищеводного сфинктера, двигательной и тонической активностью
гладкой мускулатуры пищевода. Ахалазию кардии считают редким
заболеванием: ее распространенность составляет по разным данным от 10
до 15,7 случая на 100 000 населения, а заболеваемость - 1,07-2,2 на 100
000 в год среди взрослого населения и 0,18 на 100 000 среди детей и
подростков до 16 лет.
Этиология
и патогенез ахалазии
кардии
В
настоящее время этиология ахалазии кардии остается до конца не ясной.
Однако считается, что изменения в миэнтеральном (ауэрбаховом)
межмышечном сплетении энтеральной нервной системы пищевода, ведущие к
потере функции нейронов, играют ключевую роль. В составе энтеральной
нервной системы выделяют тормозящие нейроны, нейротрансмиттерами
которых служат оксид азота (NO) и вазоактивный интестинальный пептид, и
возбуждающие нейроны, у которых медиатор представлен
ацетилхолином. начальных стадиях заболевания преобладает
воспалительный компонент с поражением главным образом тормозящих
нейронов, в которых осуществляется синтез NO и вазоактивного
интестинального пептида. При прогрессировании заболевания происходят
полная потеря этих клеток и замещение их соединительной тканью. Потеря
тормозящих NO-ергических нейронов приводит к неполному расслаблению
нижнего пищеводного сфинктера и характерному для ахалазии отсутствию
перистальтики грудного отдела пищевода. В ряде работ показан
полиморфизм генов, кодирующих все типы NO-синтазы (нейрональную (nNOS),
индуцибельную (iNOS) и эндотелиальную (eNOS)). NO-синтаза представляет
собой фермент, катализирующий образование оксида азота из аргинина,
кислорода и NADPH. Доказано, что чаще имеет место полиморфизм генов
iNOS22*A/Ab и eNOS*4a4a, которые расположены в хромосомах 12q24.2,
17q11.2 q12 и 7q36. Литературные данные последних лет свидетельствует о
том, что эозинофилы и тучные клетки также могут играть роль в развитии
ахалазии кардии. Агрегация эозинофилов и тучных клеток в пищеводе
вызывает повышение концентрации воспалительных цитокинов, что приводит
к потере ганглионарных клеток и фиброзномуремоделированию стенки
пищевода и в итоге вызывает дисфункцию пищевода и развернутую
клиническую симптоматику. В качестве основных механизмов развития
ахалазии кардии предложены следующие гипотезы:
- генетическая
предрасположенность,
- воздействие
вирусных инфекций
- идиопатические
аутоиммунные триггеры.
У
детей самой частой причиной развития ахалазии кардии является мутация
гена AAAS на хромосоме 12q13, который кодирует белок
ALacrima-Achalasia-aDrenalINsufficiency (ALADIN); мутация приводит к
развитию аутосомно-рецессивного заболевания синдрома Оллгрова (Allgrove
syndrome), характеризующегося развитием ахалазии, алакримии и болезни
Аддисона. Ахалазия встречается примерно у 75 % пациентов с синдромом и
часто является его основным клиническим проявлением. Риск развития
ахалазии у детей с синдромом Дауна в 200 раз выше, чем в общей
популяции. До 75 % из этих пациентов имеют заболевания
желудочно-кишечного тракта, и у 2 % развивается ахалазия кардии.
Классификация
ахалазии кардии
Различают
четыре стадии ахалазии кардии (по Б.В. Петровскому):
1
ст. – стадия функциональной ахалазии кардии без расширения
пищевода;
2
ст. – стойкая ахалазия кардии с умеренным расширением
пищевода;
3
ст. - стойкая ахалазия кардии с выраженным расширением пищевода;
4
ст. – стойкая ахалазия с рубцовым изменением мышечных слоёв
кардии, мешковидным расширением пищевода или его S-образным
искривлением.
Клиническая
картина ахалазии кардии
Основные симптомы
ахалазии кардии -
прогрессирующая дисфагия, регургитация и боль за грудиной, потеря веса.
 Дисфагия возникает у 99%
пациентов при употреблении твердой пищи и у 90–95% - при
употреблении жидкой. Можно выделить двахарактерных варианта
возникновения дисфагии. Так, при одном из них дисфагия развивается
остро, обычно среди полного здоровья, прослеживается связь с
психотравмирующей ситуацией. Чаще болеют молодые люди. Пациенты могут
точно указать, когда они отметили появление симптомов и с чем это было
связано. Часто дисфагия имеет парадоксальный
характер: хорошо проходит твердая пища, а жидкость задерживается.
Необходимо отметить, что нервное перевозбуждение, непривычная
обстановка, разговоры во время еды и быстрый прием пищи, особенно плохо
пережеванной и холодной, способствуют увеличению выраженности дисфагии.
Дисфагия может сопровождаться чувством задержки пищи в пищеводе на
какое-то время с последующим "проваливанием" ее в желудок. Другая форма
характеризуется постепенным развитием заболевания, часто в течение
многих лет, без парадоксальной дисфагии. Чаще болеют лица среднего и
пожилого возраста, которые не могут вспомнить, когда именно они
заболели и что послужило причиной возникновения болезни. Пациент может
самостоятельно уменьшить выраженность дисфагии, используя различные
приемы: запивание пищи большим количеством жидкости, заглатывание
воздуха, повторные глотательные движения, ходьба. Немаловажное значение
имеет и температура принимаемой пищи: большинство больных отмечают, что
лучше проходит теплая и горячая пища. Дисфагия возникает у 99%
пациентов при употреблении твердой пищи и у 90–95% - при
употреблении жидкой. Можно выделить двахарактерных варианта
возникновения дисфагии. Так, при одном из них дисфагия развивается
остро, обычно среди полного здоровья, прослеживается связь с
психотравмирующей ситуацией. Чаще болеют молодые люди. Пациенты могут
точно указать, когда они отметили появление симптомов и с чем это было
связано. Часто дисфагия имеет парадоксальный
характер: хорошо проходит твердая пища, а жидкость задерживается.
Необходимо отметить, что нервное перевозбуждение, непривычная
обстановка, разговоры во время еды и быстрый прием пищи, особенно плохо
пережеванной и холодной, способствуют увеличению выраженности дисфагии.
Дисфагия может сопровождаться чувством задержки пищи в пищеводе на
какое-то время с последующим "проваливанием" ее в желудок. Другая форма
характеризуется постепенным развитием заболевания, часто в течение
многих лет, без парадоксальной дисфагии. Чаще болеют лица среднего и
пожилого возраста, которые не могут вспомнить, когда именно они
заболели и что послужило причиной возникновения болезни. Пациент может
самостоятельно уменьшить выраженность дисфагии, используя различные
приемы: запивание пищи большим количеством жидкости, заглатывание
воздуха, повторные глотательные движения, ходьба. Немаловажное значение
имеет и температура принимаемой пищи: большинство больных отмечают, что
лучше проходит теплая и горячая пища.
Ярким симптомом заболевания является активная и пассивная регургитация,
которая отмечается у 84 и 68% больных соответственно. Активная
регургитация представляет собой срыгивание только что съеденной пищи
или слизи и более характерна для начальных стадий болезни. Она
возникает при незначительной дилатации пищевода, тогда как значительное
расширение пищевода может привести к отсроченной регургитации, объем
которой значительно больше. Пассивная регургитация возникает вне приема
пищи, обычно в горизонтальном положении пациента (симптом "мокрой подушки")
или при наклоне туловища вперед. Регургитация, особенно пассивная,
может сопровождаться аспирацией пищи в дыхательные пути, которая может
привести к нарушению функции органов дыхания, сопровождающемуся одышкой
и кашлем, и маскировать основное заболевание. Следует отметить, что
ночной кашель и симптом "мокрой подушки" свидетельствуют о
декомпенсации заболевания.
Возникновение боли у пациентов с ахалазией кардии может быть связано с
перерастяжением стенок пищевода пищевым комком, гипермоторной
дискинезией грудного отдела, с развитием застойного эзофагита. Боль
может локализоваться за грудиной, иррадиирует в спину, вверх по
пищеводу, в шею, челюсть (напоминает стенокардию). По характеру боль
может быть интенсивная спастическая при ахалазии кардии III типа,
умеренная распирающая при ахалазии кардии I типа, жгучая при эзофагите.
Интенсивность болей может быть от слабой до выраженной.
Продолжительность боли от нескольких минут до нескольких часов, может
возникать спонтанно, часто ночью, после и во время еды. Ослабевает боль
при приеме блокаторов Са2+
каналов, нитратов, глотка воды, принятия "особого" положения тела,
срыгивании.
Ещё один симптом ахалазии кардии – уменьшение массы тела,
наблюдается у 61% больных и коррелирует с тяжестью течения заболевания.
Средняя потеря массы тела составляет 5–10 кг.
В ряде случаев симптомом ахалазии кардии может быть изжога.
Диагностика
ахалазии кардии
Всем
пациентам с дисфагией и подозрением на ахалазию кардии для
подтверждения диагноза рекомендуется выполнить манометрию пищевода. При
этом манометрия пищевода признана "золотым стандартом" диагностики
ахалазии кардии.
Высокоразрешающая
манометрия
пищевода
в норме (А) и больного ахалазией кардии (Б), у которого
хорошо видны отсутствие
прогрессирования
пропульсивной волны и недостаточность
нижней полосы давления, представляющей нижний пищеводный сфинктер.
Эзофагогастродуоденоскопия
проводится для исключения других заболеваний, сопровождающихся
дисфагией. При подозрении на наличие
злокачественного процесса обязательной является биопсия для
гистологического и цитологического исследований.
Возможными эндоскопическими признаками ахалазии кардии являются:
А) расширенный или извитый пищевод и узкое желудочно-пищеводное
соединение;
Б) расширенный пищевод с задержкой слюны;
В) расширенный пищевод с застоем пищи.
Эдоскопическая
картина ахалазии
кардии
При рентгенологическом
исследовании для ахалазии кардии характерно
затруднение прохождения контрастного вещества в желудок, сужение
кардиального сегмента пищевода особой формы ("сжатый птичий клюв",
"пламя свечи", "хвост
морковки"), расширение супрастенотического его отдела и уменьшение или
отсутствие
газового пузыря желудка.
Рентгенологическая
картина ахалазии
кардии 2 стадии.
Рентгенологическая
картина ахалазии
кардии 3 стадии:
1 –
супрастенотическое
расширение пищевода с уровнем жидкости; 2 - признак "сжатого
птичьего клюва"
нижнего пищеводного сфинктера"; 3 - желудок.
Рентгенологическая
картина ахалазии
кардии 4 стадии, прямая (а) и боковая (б) проекции.
S-образное
искривление пищевода.
Лечение
ахалазии кардии
Лечение
ахалазии кардии может быть медикаментозным, эндоскопическим,
направленным на регулирование тонуса и моторики пищевода и кардии с
сохранением всех анатомических структур, и хирургическим.
Медикаментозное лечение
Пациентам
с ахалазией кардии, проявляющейся болью в грудной клетке,
рекомендуется назначать препараты, оказывающие расслабляющее действие
на гладкую мускулатуру грудного отдела пищевода (блокаторы Са2+
каналов, нитраты).
Эндоскопическое лечение
Ступенчатая
нефорсированная баллонная
пневмодилатация является эффективным и достаточно безопасным
методом лечения ахалазии кардии и является "золотым стандартом" её
нехирургического лечения. Она выполняется под рентгенологическим или
эндоскопическим контролем с целью растяжения мышечных волокон
пищеводно-желудочного перехода вплоть до надрыва, в результате чего
снижается давление нижнего пищеводного сфинктера и улучшается пассаж
пищи по пищеводу.
Этапы баллонной
кардиодилатации под
контролем рентгентелевидения.
Дилатации
обычно проводят через день, постепенно повышая давление (от 180 до 320
мм рт. ст.; до 2-4 атм.). Критериями эффективности лечения являются
исчезновение дисфагии и снижение градиента пищеводно-желудочного
давления до нормальных цифр. Обычно курс лечения состоит из
5–6 дилатаций. В настоящее время используются как
пневматические
так и гидростатические кардиодилататоры.
Пневматический
кардиодилататор.
У
большинства
больных уже в процессе лечения значительно уменьшается дисфагия,
сокращается диаметр пищевода, восстанавливается газовый пузырь желудка,
а после окончания курса лечения пациенты обычно могут свободно
принимать любую пищу.
Пероральная
эндоскопическая кардиомиотомия была разработана в качестве
эндоскопического метода лечения ахалазии кардии, который является
эффективным и
малоинвазивным. Всем пациентам с ахалазией кардии при проведении
пероральной эндоскопической кардиомиотомии рекомендуется выполнить
рассечение мышечного слоя желудка в длину не менее 2–3 см, что
оптимально для достижения целевых показателей операции.
Пероральная эндоскопическая
кардиомиотомия.
A: коагуляция подслизистых сосудов; Б: разрез слизистой оболочки;
В: первый ряд швов; Г: второй ряд швов.
Новым
достижением в эндоскопическом лечении ахалазии кардии является инъекция
в
нижний
пищеводный сфинктер ботулотоксина. Метод основан на том,
что
ботулинический токсин А, используемый для лечения ахалазии кардии,
блокирует высвобождение ацетилхолина из нервных окончаний в
синаптическую щель, что приводит к временному расслаблению мышечных
волокон нижнего пищеводного сфинктера. Он рекомендуется пациентам с
ахалазией кардии в качестве эффективной и безопасной терапии только для
временного облегчения симптомов заболевания. Предварительные сообщения
свидетельствуют об удовлетворительных результатах такого лечения. У
больных ахалазией кардии, не леченных до этого с помощью
кардиодилатации или миотомии, инъекции ботулотоксина приводили к
уменьшению диссрагии, регургитации, болей за грудиной, снижению
давления в нижнем пищеводном сфинктере, уменьшению диаметра расширенной
части пищевода.
Хирургическое лечение
Стандартом
хирургического лечения ахалазии кардии является лапароскопическая
эзофагокардиомиотомия, в основе которой лежит
рассечение мышечного слоя пищевода по передней стенке органа с
переходом на переднюю стенку желудка в зоне кардии. Следствием
вмешательства является снижение тонуса кардии и устранение
дисфагии с эффективностью 80–90 %. Показанием к хирургическому
лечению больных ахалазией кардии является, главным образом,
неэффективность баллонной пневмодилатации кардии.
Эзофагокардиомиотомия
с
неполной
фундопликацией.
ДИВЕРТИКУЛЫ
ПИЩЕВОДА
 Дивертикулами
называются слепо оканчивающиеся мешковидные выпячивания ограниченного
участка любого полого органа, сообщающееся с его просветом. По
распространённости дивертикулы пищевода занимают второе место после
дивертикулов 12 п. кишки. Это одно из самых распространённых
доброкачественных заболеваний пищевода. Дивертикулы
наблюдаются редко в возрасте до 30 лет и часто после 50
лет; среди больных преобладают мужчины. Наиболее часто дивертикулы
встречаются в грудном отделе пищевода. Дивертикулами
называются слепо оканчивающиеся мешковидные выпячивания ограниченного
участка любого полого органа, сообщающееся с его просветом. По
распространённости дивертикулы пищевода занимают второе место после
дивертикулов 12 п. кишки. Это одно из самых распространённых
доброкачественных заболеваний пищевода. Дивертикулы
наблюдаются редко в возрасте до 30 лет и часто после 50
лет; среди больных преобладают мужчины. Наиболее часто дивертикулы
встречаются в грудном отделе пищевода.
Классификация дивертикулов
пищевода
I.
По
механизму развития:
- тракционные:
образуются
вследствие натяжения
стенки пищевода спайками с различными органами. Они имеют треугольную
форму, никогда не достигают больших размеров и, как правило, хорошо
опорожняются.
- пульсионные:
образуются
в результате
локальной слабости пищеводной стенки. В механизме их развития большая
роль отводится давлению пищевого комка изнутри пищевода при прохождении
пищи. Для пульсионных дивертикулов характерна округлая или грибовидная
форма. Они плохо опорожняются и могут достигать огромных размеров.
II.
В
зависимости от расположения:
- глоточно-пищеводные
(ценкеровские);
- бифуркационные
(эпибронхиальные,
среднепищеводные);
- эпифренальные
(эпидиафрагмальные).
Локализация
дивертикулов
пищевода.
1 -
глоточно-пищеводный (Ценкера); 2 - бифуркационный; 3 - эпифренальный.
III. По гистологической структуре:
- истинные,
стенка
которых содержит все слои стенки пищевода;
- ложные,
в стенке
которых отсутствует мышечный слой.
IV.
По происхождению:
- приобретенные;
- врожденные
(встречаются крайне редко).
При
нарушениях моторики пищевода
(эзофагоспазм) могут наблюдаться так
называемые псевдодивертикулы,
возникающие только в момент
сокращения пиищевода, при расслаблении пищевода они исчезают.
Клиника дивертикулов
пищевода
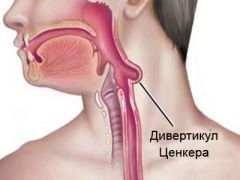 Глоточно-пищеводные
дивертикулы
(дивертикулы Ценкера)
относятся к наиболее редким (3-5 %). Они, как правило, пульсионные.
Дивертикулы Ценкера выявляются обычно в возрасте 40-60 лет, причем у
мужчин в 2-3 раза чаще, чем у женщин, вследствие больших размеров их
гортаноглотки. Они имеют характерную локализацию - заднюю стенку глотки
и пищевода. Глоточно-пищеводные
дивертикулы
(дивертикулы Ценкера)
относятся к наиболее редким (3-5 %). Они, как правило, пульсионные.
Дивертикулы Ценкера выявляются обычно в возрасте 40-60 лет, причем у
мужчин в 2-3 раза чаще, чем у женщин, вследствие больших размеров их
гортаноглотки. Они имеют характерную локализацию - заднюю стенку глотки
и пищевода.
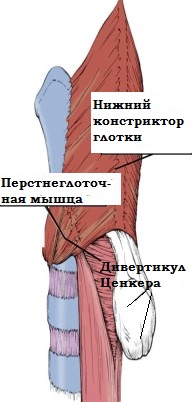 В
этом слабом месте пищевода выделены два пространства (треугольника).
Границей между ними являются циркулярные волокна перстнеглоточной
мышцы. В норме сокращение мощного констриктора глотки, создающее
впрыскивающий эффект, сопровождается расслаблением перстнеглоточной
мышцы
и полным раскрытием устья пищевода. Дискоординация мышц глотки и
пищевода любой этиологии вместе с механическим давлением пищевого комка
создает в треугольнике Киллиапа мешковидное выпячивание - пульсионный
дивертикул Ценкера. Этиологические факторы по данным литературы
многообразны. К ним относят пороки эмбрионального развития,
наследственные факторы, приобретенные дефекты мышечных волокон, травмы
слизистой оболочки, повреждения позвоночника, врожденную гипотонию
мышц, воспалительные процессы в глотке или пищеводе, инволютивные
факторы (склероз, окостенение хрящей) и др. Наиболее признана
множественная этиология формирования дивертикулов Ценкера. В
этом слабом месте пищевода выделены два пространства (треугольника).
Границей между ними являются циркулярные волокна перстнеглоточной
мышцы. В норме сокращение мощного констриктора глотки, создающее
впрыскивающий эффект, сопровождается расслаблением перстнеглоточной
мышцы
и полным раскрытием устья пищевода. Дискоординация мышц глотки и
пищевода любой этиологии вместе с механическим давлением пищевого комка
создает в треугольнике Киллиапа мешковидное выпячивание - пульсионный
дивертикул Ценкера. Этиологические факторы по данным литературы
многообразны. К ним относят пороки эмбрионального развития,
наследственные факторы, приобретенные дефекты мышечных волокон, травмы
слизистой оболочки, повреждения позвоночника, врожденную гипотонию
мышц, воспалительные процессы в глотке или пищеводе, инволютивные
факторы (склероз, окостенение хрящей) и др. Наиболее признана
множественная этиология формирования дивертикулов Ценкера.
Дивертикул увеличивается крайне медленно, годами, его размеры
колеблются от вишни до размеров детской головки. Тело и шейка
дивертикула выстланы слизистой оболочкой и содержат иногда до 1,5 л
жидкости (эзофагоцеле). Чаще дивертикул Ценкера лежит превертебрально в
сторону верхнего средостения, сзади или левее пищевода. Изредка он
может проникать в продольные мышечные щели стенки пищевода
(интрамуральный дивертикул Ценкера). Крупные дивертикулы медленно
сдавливают соседние органы и ткани, не срастаясь и не вызывая в них
воспалительного процесса, пока не разовьются дивертикулит и
перидивертикулит.
Небольшой глоточно-пищеводный
(ценкеровский) дивертикул проявляется чувством першения,
царапания
в горле, сухим кашлем, ощущением инородного тела в глотке, повышенной
саливацией, иногда спастической дисфагией. По мере увеличения
дивертикула наполнение его пищей может сопровождаться булькающим шумом
при глотании, приводить к развитию дисфагии разной степени
выраженности, к появлению выпячивания на шее, которые можно
обнаружить при осмотре и пальпации шеи, особенно при
отведении головы
назад.
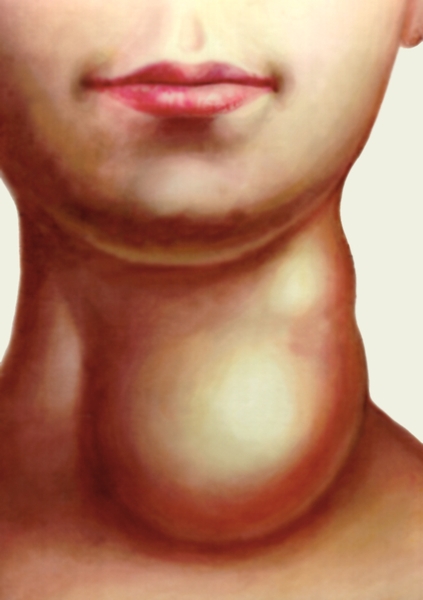 Выпячивание
имеет мягкую консистенцию, уменьшается при
надавливании, после приема воды при перкуссии над ним можно
определить шум плеска. Возможна спонтанная регургитация непереваренной
пищи из просвета дивертикула при определенном положении больного,
затруднение дыхания из-за сдавливания трахеи, появление осиплости
голоса при сдавлении возвратного нерва При приеме пищи у больных может
развиться "феномен блокады", проявляющийся покраснением лица, ощущением
нехватки воздуха, головокружением, обморочным состоянием, исчезающим
после рвоты. При длительной задержке пищи в дивертикуле появляется
гнилостный запах изо рта. У большинства больных нарушается питание, что
приводит их к истощению. Выпячивание
имеет мягкую консистенцию, уменьшается при
надавливании, после приема воды при перкуссии над ним можно
определить шум плеска. Возможна спонтанная регургитация непереваренной
пищи из просвета дивертикула при определенном положении больного,
затруднение дыхания из-за сдавливания трахеи, появление осиплости
голоса при сдавлении возвратного нерва При приеме пищи у больных может
развиться "феномен блокады", проявляющийся покраснением лица, ощущением
нехватки воздуха, головокружением, обморочным состоянием, исчезающим
после рвоты. При длительной задержке пищи в дивертикуле появляется
гнилостный запах изо рта. У большинства больных нарушается питание, что
приводит их к истощению.
Глоточно-пищеводные
(ценкеровские)
дивертикулы могут осложняться развитием дивертикулита, который в свою
очередь может стать причиной флегмоны шеи, медиастинита,
развития пищеводного свища, сепсиса.
Регургитация и аспирация содержимого дивертикула приводят к хроническим
бронхитам, повторным пневмониям, абсцессам
легких. Возможны кровотечение из
эрозированной слизистой
оболочки
дивертикула, развитие в нем полипов, малигнизация его стенки.
На
долю бифуркационных
дивертикулов
приходится 70-80 % всех дивертикулов пищевода. Как и дивертикулы
Ценкера, они возникают в возрасте 40-60 лет, но чаще у женщин
(соотношение 3:2). Большинство таких дивертикулов локализуется над
бронхом в аортальном и бронхиальном сегментах, реже - в подбронхиальном
сегменте.
Бифуркационные дивертикулы бывают пульсионными, но чаще они тракционные
или смешанные. Их происхождение до сих пор вызывает споры
исследователей. Одни авторы придерживаются концепции, согласно которой
они являются врожденными неполными бронхоэзофагеальными свищами,
находящимися в длительной "спячке" до возникновения тракции или
пульсации. Другие авторы придерживаются мнения о приобретенном
характере бифуркационных дивертикулов, считая их следствием
хронического параэзофагеального воспалительного процесса. В настоящее
время этиология бифуркационных дивертикулов остается неясной, а
патогенез (тракционный механизм) бесспорен. Патологоанатомически эти
дивертикулы при спавшихся стенках пищевода часто не видны.
Бифуркационные
дивертикулы
чаще всего
характеризует бессимптомное
течение, возможны явления дисфагии, боли за грудиной или в спине, при
хроническом дивертикулите - прорыв в трахею, аспирация, развитие
бронхопневмонии, абсцесса
легкого.
Эпифренальные
дивертикулы
- это обычно пульсионные дивертикулы наддиафрагмального и, редко,
ретроперикардиального сегментов пищевода. Они встречаются намного реже
бифуркационных, но в 2-3 раза чаще, чем дивертикулы Ценкера. Их частота
по данным литературы составляет 10-15 % всех дивертикулов пищевода;
поражаются женщины в возрасте 50-60 лет в 2 раза чаще, чем мужчины.
Причины возникновения и патогенез раскрыты не полностью. Популярной, но
до сих пор не подтвержденной остается концепция, по которой
эпифренальпые дивертикулы возникают в месте вхождения питающих орган
кровеносных сосудов. Наддиафрагмальные истинные дивертикулы пищевода,
как правило, содержат все слои стенки пищевода, исходят только из
передней или левой Гюковой стенки. Обычно при дивертикулах пищевода у
лиц старше 50 лет ампула пищевода не выявляется, но можно наблюдать
частые спазмы выше диафрагмального сфинктера. Это позволяет
предполагать, что после 50 лет врожденные или приобретенные изменения
передней стенки наддиафрагмального сегмента, сочетаясь с дисфункцией
сфинктера кардии, трансформируют эпифренальную ампулу в эпифренальный
дивертикул передней стенки. Переход функциональной фазы в органическую
является вариантом перехода релаксационного дивертикула в пульсионный.
Престенотический эпифренальный дивертикул пищевода часто сочетается с
кардиоспазмом (ахалазия), по данным литературы, в 6-65 % случаев.
Вероятно, наблюдаемые в клинике сочетания эпифренального дивертикула и
диафрагмальной грыжи следует объяснять не традиционным механизмом
рефлюкс-эзофагита, а декомпенсацией длительного функционального
кардиоспазма (гиперкинетического варианта функциональной болезни
пищевода).
Эпифренальные
дивертикулы также у большинства больных протекают
бессимптомно, но могут проявляться болями за нижней частью грудины,
аэрофагией, тошнотой, рвотой, рефлекторной одышкой, сердцебиением,
бронхоспазмом, симптомами сдавления пищевода и кардиоспазма. Течение
заболевания медленное, без существенного прогрессирования.
При
длительной задержке пищевых масс в бифуркационных и эпифренальных
дивертикулах могут возникать осложнения: дивертикулит, медиастинальный
абсцесс с прорывом в бронх, пищевод, перикард и другие органы
средостения, массивное кровотечение. Хронический дивертикулит
предрасполагает к возникновению рака.
Диагностика
дивертикулов пищевода
Основным
методом диагностики дивертикулов пищевода является рентгеноконтрастное
исследование, устанавливающее наличие дивертикула,
ширину шейки, длительность задержки в нем бария, степень нарушения
проходимости пищевода, признаки развития в дивертикуле полипа и рака,
формирование пищеводно-бронхиального и пищеводно медиастинальных
свищей.
Рентгенологическая
картина дивертикула Ценкера (стрелка).
Рентгенологическая
картина бифуркационного тракционного
дивертикула пищевода (стрелки).
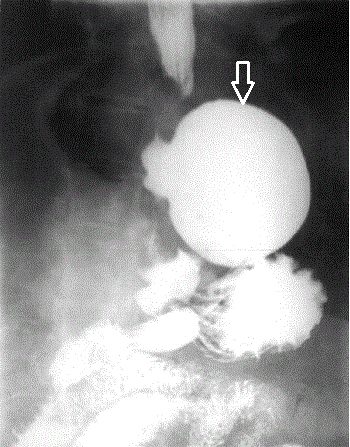
Рентгенологическая
картина эпифренального пульсионного
дивертикула пищевода (стрелка).
Эндоскопическое
исследование - дивертикулоскопия - дает возможность выявить дивертикул,
обнаружить изъязвление его слизистой оболочки, наличие кровотечения,
диагностировать полип или рак в дивертикуле. Проводить исследование
нужно очень осторожно в связи с возможностью перфорации дивертикула.
Эндоскопическая
картина тракционного
дивертикула пищевода.
Лечение
дивертикулов
пищевода
Основной
метод лечения пульсионных дивертикулов пищевода –
хирургический.
Только при наличии противопоказаний к операции прибегают к
консервативной терапии, которая лишь облегчает состояние больного и в
какой-то мере предупреждает возникновение осложнений. Для
устранения застоявшихся масс применяются периодические промывания
дивертикула, вызывающие временное облегчение, однако с каждым приёмом
пищи дивертикул снова наполняется, всё больше растягивается и всё
сильнее сдавливает пищевод.
Также
показанием к хирургическому лечению дивертикулов пищевода являются
осложнения (перфорация, пенетрация, кровотечение, стеноз пищевода, рак,
развитие свищей), большие дивертикулы, осложненные хотя бы
кратковременной задержкой в них пищевых масс, длительная задержка пищи
в дивертикуле независимо от его размеров.
Операция заключается в удалении дивертикула (используются
также
термины "дивертикулэктомия" и "резекция дивертикула"). В зависимости от
локализации дивертикула выбирают операционный доступ:
при глоточно-пищеводных - левосторонний шейный, при эпибронхиальных -
правосторонний
трансторакальный, при эпифренальных - левосторонний трансторакальный.
Для удаления дивертикула Ценкера применяют левосторонний доступ по
переднему краю грудинно-ключично-сосцевидной мышцы. Эту мышцу и
сосудистый пучок шеи отводят латерально, а щитовидную железу с трахеей
– медиально. Находят и выделяют дивертикул до шейки.
Дивертикул
отсекают после наложения на шейку сшивающего аппарата. Затем делают
рассечение крикофарингеальной мышцы – с учетом ее роли в
патогенезе заболевания – на протяжении 1,5–2 см без
повреждения слизистой пищевода.
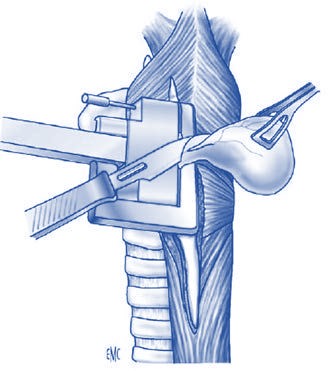
Резекция
дивертикула Ценкера с
крикофарингеальной миотомией.
Мини-инвазивное удаление эпифренального дивертикула: выделяют
дивертикул из окружающих тканей
до шейки, производят миотомию, иссекают его и ушивают отверстие в
стенке пищевода. При значительном мышечном дефекте или атрофии мышечных
волокон пищевода производят пластическое восстановление его стенки
лоскутом диафрагмы, плевры. Инвагинацию выполняют только при небольших
размерах дивертикулов. Летальность после операции составляет 1-1,5 %.
а
б
в
Мини-инвазивное
удаление
эпифренального дивертикула пищевода.
а - степлерная
дивертикулэктомия; б
- миотомия пищеводно-желудочного перехода; в - фундопликация по
Ниссену-Розетти.
В
последние годы распространилась эндоскопическая операция рассечения
перегородки между дивертикулом и пищеводом при помощи
сшивающего
аппарата (степлера), лазерного или электрического каутера. Дивертикул
при этом остается, но хорошо дренируется; дисфагия исчезает. Такое
вмешательство занимает небольшое время и может выполняться при
отсутствии общего обезболивания.
а
б
Эндоскопическое
рассечение
перегородки между дивертикулом и пищеводом.
а - вид дивертикулярной перегородки при дивертикулоскопии; б -
пересечение дивертикулярной
перегородки при
помощи LIGASURЕTM.
Больные
с тракционными неосложнёнными, хорошо опорожняющимися дивертикулами
пищевода в хирургическом лечении, как правило, не
нуждаются. Им
проводят консервативную терапию, направленную на профилактику задержки
пищевых масс в дивертикуле и уменьшение возможности развития
дивертикулита. Пища должна быть полноценной, механически, химически и
термически щадящей. Больным рекомендуют питаться хорошо измельченной
пищей. После еды следует выпивать несколько глотков воды, принимать
положение, способствующее опорожнению дивертикула.
РАК
ПИЩЕВОДА
Статистика
и эпидемиология рака пищевода
Среди
других локализаций злокачественных новообразований рак пищевода
занимает пятое место у мужчин (6,2 %) и седьмое у женщин (4,8 %). В
большинстве стран мира смертность от рака пищевода у мужчин в 2-3 раза,
а во Франции - в 8 раз выше, чем у женщин. Заболевают раком пищевода
обычно лица старше 50 лет, что характерно для всех стран. В возрасте
40-49 лет на 100 ООО населения заболевает 6,6 человека, а старше 70 лет
- 97,1 человека.
 Причины,
способствующие возникновению рака пищевода, разнообразны. К ним, прежде
всего, следует отнести
неблагоприятное влияние курения табака, приём чрезмерно горячей
пищи, крепких напитков, наличие в пище канцерогенных веществ,
образующихся в процессе ее обработки. Перечисленные неблагоприятные
факторы могут быть причиной возникновения хронических эзофагитов,
лейкоплакий, которые в свою очередь являются фоном для развития
злокачественной опухоли. Подвергаться процессу малигнизации могут
полипы и папилломы пищевода; липомы, лейомиомы и дивертикулы имеют
меньше значение. Причины,
способствующие возникновению рака пищевода, разнообразны. К ним, прежде
всего, следует отнести
неблагоприятное влияние курения табака, приём чрезмерно горячей
пищи, крепких напитков, наличие в пище канцерогенных веществ,
образующихся в процессе ее обработки. Перечисленные неблагоприятные
факторы могут быть причиной возникновения хронических эзофагитов,
лейкоплакий, которые в свою очередь являются фоном для развития
злокачественной опухоли. Подвергаться процессу малигнизации могут
полипы и папилломы пищевода; липомы, лейомиомы и дивертикулы имеют
меньше значение.
В последние десятилетия рак пищевода приковывает к себе
все большее
внимание. Сегодня мы имеем дело, по существу, с двумя
разными заболеваниями. Плоскоклеточный рак пищевода и аденокарцинома
нижней трети пищевода, чаще
возникающая на фоне пищевода
Барретта,
отличаются по морфологическому
субстрату, причинам возникновения, путям
раннего метастазирования, чувствительности к химио-
и
радиотерапии, распространенности среди пациентов разных рас.
Развитие пищевода Барретта является одним из
грозных
осложнений рефлюкс-эзофагита. Возникновение в пищеводе очагов
специализированного цилиндрического эпителия, метаплазированного по
кишечному типу, принято рассматривать как облигатный предрак.
Частота развития аденокарциномы в пищеводе Барретта
стремительно меняет структуру заболеваемости раком пищевода жителей
развитых странах.
Классификации
рака пищевода
По
локализации опухолевого процесса выделяют следующие формы рака пищевода:
I.
Пищеводно-глоточный. 2. Шейный. 3. Верхнегрудной. 4.
Ретро-бифуркационный. 5. Субаортальный. 6. Среднегрудной. 7.
Наддиафрагмальный. 8. Диафрагмальный. 9. Абдоминальный.
Классификация
рака пищевода по стадиям заболевания:
I
стадия - четко отграниченная небольшая опухоль, прорастающая
только слизистый и подслизистый слои. Опухоль суживает просвет
пищевода, но мало затрудняет прохождение пищи. Клинических проявлений
нет. Метастазы отсутствуют.
II
стадия - опухоль или язва, прорастающая мышечный слой
пищевода,
но не выходящая за его пределы и занимает не более 1/4 периметра
пищевода. Опухоль значительно нарушает
проходимость пищевода. Имеются единичные метастазы в регионарные
лимфатические узлы.
III
стадия - опухоль или язва, занимающая больше полуокружности
пищевода и циркулярно охватывающая ее, прорастающая всю стенку
пищевода и окружающую клетчатку, спаянная с соседними органами.
Проходимость пищевода нарушена значительно или полностью. Имеются
множественные метастазы в регионарные лимфатические узлы.
IV
стадия - опухоль, прорастающая пищевод циркулярно; выходит за
пределы органа, вызывает пенетрацию в ближайшие органы. Имеются
конгломераты неподвижных регионарных метастатических лимфатических
узлов и метастазы в отдаленные органы.
Международная
классификация
рака пищевода по системе TNM:
Т
- первичная
опухоль.
Т0
- нет
проявлений первичной опухоли.
Tl
- опухоль
поражает не менее 5 см длины пищевода, не вызывает сужения просвета, не
охватывает пищевода циркулярно и не распространяется за пределы органа.
Т2
- опухоль поражает более 5 см пищевода, распространяется
циркулярно или вызывает сужение просвета. За пределы органа опухоль не
прорастает.
Т3
- опухоль
любого размера, распространяющаяся на соседние образования: поражение
диафрагмального, возвратного или симпатического нервов; образование
пищеводно-трахеального или бронхиального свищей; прорастание трахеи или
бронхов, крупных сосудов, плевральный выпот.
N
- регионаркые лимфатические узлы. Поскольку оценить состояние
внутригрудных лимфоузлов невозможно, следует использовать символ NX,
используемый в дальнейшем при получении соответствующих сведений может
быть дополнен данными гистологического исследования лимфатических узлов
(+ или - ).
N0
- регионарные
лимфатические узлы не поражены.
N1
- признаки
поражения регионарных лимфатических узлов.
М
- отдаленные
метастазы.
М0
- отдаленных
метастазов нет.
Ml
- признаки
поражения отдаленных органов метастазами.
Метастазирование рака пищевода идет как лимфогенным, так и гематогенным
путем. По лимфатическим сосудам опухолевые клетки метастазируют как по
длиннику пищевода, так и в регионарные лимфатические узлы.
Выделяют 2
этапа регионарного метастазирования: I - параэзофагеальные
лимфатические узлы, II - бифуркационные, паратрахеальные,
паракардиальные и надключичные лимфатические узлы. Метастазы в
различных группах лимфатических узлов обнаруживаются более чем у 50 %
радикально оперированных больных.
Направление метастазирования зависит от локализации опухоли и
соответствующего ей пути лимфооттока. При раке нижней трети пищевода
метастазы, как правило, обнаруживаются в прилежащих к опухоли
параэзофагеальных лимфоузлах и лимфоузлах паракардиальной области, а
также в лимфоузлах по ходу чревной артерии. При раке средней трети
метастазы обычно имеются в параэзофагеальных, бифуркационны прикорневых
и паракардиальных лимфатических узлах. При раке верхней трети пищевода
опухоль метастазирует в париэзофагеальные, паратрахеальные и
надключичные лимфатические узлы. При блокировании путей лимфооттока
раковые клетки могут распространяться ретроградно. Гематогенное
метастазирование приводит к возникновению метастазов в легких, печени и
других органах.
Для аденокарциномы, возникшей в пищеводе Барретта, характерно более
позднее метастазирование в лимфоузлы заднего средостения, чем
при
плоскоклеточном раке, вероятно, из-за выраженного периэзофагита,
связанного с длительно текущим рефлюкс-эзофагитом. Подобно раку кардии,
метастазирование аденокарциномы Барретта происходит в 3
региона с
преимущественным поражением лимфоузлов заднего средостения, вплоть до
бифуркации трахеи и чревного ствола. По сравнению с плоскоклеточным
раком метастатическое поражение лимфоузлов шеи и верхнего
средостения при аденокарциноме Барретта обычно свидетельствует о
системном поражении и невозможности радикального вмешательства.
Патологическая
анатомия рака
пищевода
Обычно
пользуются делением пищевода на 3 отдела: верхняя треть - до дуги
аорты, средняя - от верхнего края дуги аорты до нижней легочной вены, и
нижняя - от последней до кардии. Если исключить рак, распространяющийся
на пищевод из кардиального отдела желудка (аденокарциномы), то наиболее
частой локализацией опухоли является средняя треть пищевода, реже -
нижняя и еще реже - верхняя треть. Эти соотношения выражаются
приблизительно как 9:3:1.
По размеру раковая опухоль может быть различной и занимать по длиннику
пищевода от 1 до 15 см. Направление роста опухоли идет не только вдоль
стенки пищевода, но и за ее пределы, в прилежащие к пищеводу ткани и
органы. Операбельность, прежде всего, зависит от поперечного размера
опухоли.
По гистологической структуре рак пищевода в подавляющем большинстве
плоскоклеточный (93-95 %): неороговевающие и ороговевающие формы.
Аденокарциномы составляют 3-5 % и развиваются из слизистых желез
пищевода. Чрезвычайно редко встречаются смешанные формы, состоящие из
железистых и плоскоклеточных структур, такой рак называют акантомой.
Плоскоклеточный ороговевающий рак пищевода локализуется, как правило, в
верхней и средней трети, неороговевающий - в средней и нижней трети,
аденогенный - чаще в нижней трети.
Общепризнанной макроскопической классификации рака пищевода не
существует. Описывают экзофитный или узловой рак, при котором узлы
опухоли, различные по размеру, вдаются в просвет пищевода и растягивают
его. Эндофитный - в виде плоской, быстро изъязвляющейся опухоли.
Инфильтрация распространяется на всю толщу стенки пищевода и далеко
вдоль пищевода по подслизистому слою, инфильтрат плотный.
Склерозирующая форма в виде плотных, быстро изъязвляющихся узелков,
инфильтрирует подслизистый и часто мышечный слой и распространяется по
периметру пищевода. Складки слизистой оболочки при склерозирующем раке
конвергируют к язве. Пораженный опухолью пищевод резко суживается,
вплоть до полной непроходимости даже при небольшом размере опухоли.
О форме опухоли можно судить в начале заболевания. По мере ее роста и
вовлечения в процесс прилежащих тканей и органов, метастазирования в
лимфатические узлы возникает конгломерат, не позволяющий сделать вывод
о макроскопической форме исходного процесса.
При поражении верхней трети пищевода в опухолевый инфильтрат обычно
вовлекается трахея, средней трети - бифуркация трахеи, непарная и
верхняя полая вена, корень легкого, аорта. Часто поражается возвратный
нерв. В нижней трети пищевод более подвижен, окружен клетчаткой, в
связи с чем опухоль прорастает в прилежащие органы реже.
Клиническая
картина рака пищевода
Клинические
признаки рака пищевода подразделяют на три основные группы:
- симптомы
поражения пищевода;
- общие
симптомы;
- симптомы
вовлечения в патологический процесс соседних органов.
Начало
развития рака пищевода проходит бессимптомно. Латентный период может
длиться 1-2 года. Дисфагия
(у 70-98 % больных)
является первым симптомом заболевания, но
по существу - это поздний симптом, возникающий при закрытии просвета
пищевода опухолью на 2/3 и более, при этом у 60 % больных имеются
метастазы в лимфоузлах. Для рака характерно прогрессирующее нарастание
непроходимости пищевода, которое у одних больных развивается быстро, у
других - медленно (в течение 1,5-2 лет). Нарушение проходимости
пищевода связано не только с сужением его просвета опухолью, но может
быть обусловлено развитием перифокального воспаления, возникновением
спазма пищевода при поражении опухолью интрамуральных нервных
сплетений. Чаще спастические явления отмечают при эндофитных опухолях.
В начальном периоде заболевания дисфагия возникает при проглатывании
плотной или недостаточно пережеванной пищи. Больные ощущают как бы
"прилипание" ее к стенке пищевода или временную задержку на
определенном уровне. Глоток воды обычно устраняет эти явления. В
дальнейшем перестает проходить даже хорошо прожеванная пища, и больные
вынуждены принимать полужидкую и жидкую пищу, дисфагия делается
постоянной и возникает даже при употреблении жидкости. Иногда после
стойкого периода дисфагии возникает улучшение проходимости пищи по
пищеводу, связанное с распадом опухоли. Возникновению дисфагии могут
предшествовать появляющиеся при проглатывании твердой пищи ощущения
инородного тела в пищеводе, чувство "царапания" за грудиной,
болезненность на уровне поражения.
 Боль
(у 33 %)
- частый симптом рака пищевода. Боли за грудиной тупого
тянущего характера возникают во время приема пищи, могут
иррадиировать в спину, шею, левую половину грудной клетки. Механизм
возникновения болей различный. Боли за грудиной, возникающие во время
приема пищи, обусловлены травмированном пищей воспаленной стенки
пищевода около опухоли и эзофагоспазмом. Тупые схваткообразные боли во
время приема пищи возникают при обтурации пищевода опухолью. В этом
случае появление болей связано с усиленным сокращением
стенки пищевода, направленным на продвижение пищи через суженный
участок. Постоянные боли, не зависящие от приема пищи или усиливающиеся
после еды, обусловлены прорастанием опухоли в окружающие пищевод ткани
и органы, сдавлением блуждающих и симпатических нервов, развитием
периэзофагита и медиастинита. Причиной болей могут быть метастазы в
позвоночник. Боль
(у 33 %)
- частый симптом рака пищевода. Боли за грудиной тупого
тянущего характера возникают во время приема пищи, могут
иррадиировать в спину, шею, левую половину грудной клетки. Механизм
возникновения болей различный. Боли за грудиной, возникающие во время
приема пищи, обусловлены травмированном пищей воспаленной стенки
пищевода около опухоли и эзофагоспазмом. Тупые схваткообразные боли во
время приема пищи возникают при обтурации пищевода опухолью. В этом
случае появление болей связано с усиленным сокращением
стенки пищевода, направленным на продвижение пищи через суженный
участок. Постоянные боли, не зависящие от приема пищи или усиливающиеся
после еды, обусловлены прорастанием опухоли в окружающие пищевод ткани
и органы, сдавлением блуждающих и симпатических нервов, развитием
периэзофагита и медиастинита. Причиной болей могут быть метастазы в
позвоночник.
Срыгивание пищей и пищеводная рвота (у 23 %) появляются при
значительном
стенозировании просвета пищевода и скоплении пищи над местом сужения.
Рвотные массы состоят из непереваренной пищи, слюны и слизи, иногда с
примесью крови. Некоторые больные искусственно вызывают рвоту для
снятия ощущения распирания за грудиной и болей, появляющихся во время
еды. Дурной запах изо рта отмечается в связи с разложением
задержавшейся над опухолью пищи или распадом самой опухоли.
Тошнота и отрыжка наблюдаются у больных при инфильтрации опухолью
стенок пищевода в области физиологической кардии.
Усиленное слюнотечение, при раке пищевода, как и при стенозах другой
этиологии, возникает в результате рефлекторного возбуждения слюнных
желез при раздражении рецепторов пищевода и блуждающих нервов. Обильные
кровотечения из пищевода в связи с распадом опухоли бывают редко.
Общие проявления заболевания (слабость, прогрессирующее похудание (у
51 %), анемия) являются следствием голодания и интоксикации.
Симптомы рака пищевода, возникающие вследствие распространения процесса
на соседние органы и ткани, относят к поздним проявлениям болезни,
обычно они свидетельствуют о неоперабельности опухоли. При прорастании
опухолью возвратных нервов у больных развивается охриплость голоса,
поражение узлов симпатического нерва, проявляется синдром Горнера:
сужение глазной щели (птоз); сужение зрачка (миоз); более глубокое в
сравнении с нормой положение глазного яблока
(энофтальм). Сдавление блуждающего нерва может вызывать
брадикардию, приступы кашля,
рвоту. Прорастание опухолью диафрагмального нерва сопровождается
параличом диафрагмы на соответствующей стороне, а плечевого сплетения -
болью, парестезией, а затем параличом верхней конечности. Переход
опухоли на гортань сопровождается изменением звучания голоса,
появлением одышки и стридорозного дыхания. При сдавлении (прорастании)
трахеи и бронхов возникает кашель, одышка (у 7,2 %). Образование
пищеводно-трахеального или пищеводно-бронхиального свища проявляется
кашлем при приеме жидкости. Это осложнение обычно заканчивается
развитием пневмонии, абсцесса
или гангрены
легкого.
Вследствие перехода
инфекции с пищевода могут развиваться периэзофагит, медиастинит,
перикардит. При разрушении опухолью стенки крупного сосуда возникают
массивные кровотечения. При срыгиваниях и пищеводных рвотах возможно
попадание пищевых масс в трахеобронхиальное дерево и развитие тяжелых
воспалительных легочных осложнений. Клиническое течение болезни зависит
от уровня поражения пищевода.
Рак верхнегрудного и шейного отделов пищевода протекает особенно
мучительно. Вначале больные жалуются на ощущение инородного тела,
царапанье, жжение в пищеводе во время еды. Позднее появляются симптомы
глоточной недостаточности - частые срыгивания, поперхивание, приступы
асфиксии.
При раке среднегрудного отдела пищевода нередко на первое место
выступает дисфагия, затем появляются симптомы прорастания опухоли в
соседние органы и ткани (корни легких, грудной лимфатический проток,
блуждающий и симпатический нервы, позвоночник и др.). У этих больных
возникают тяжелые осложнения: медиастиниты, трахео- и бронхопищеводные
свищи, кровотечения, плевриты и др., от которых они и умирают.
Рак нижней трети пищевода проявляется часто болями в эпигастральной
области, иррадиирующими в левую половину грудной клетки и симулирующими
стенокардию. Происхождение подобных болей связано с прорастанием
опухолью диафрагмального нерва. Упорные боли в левой половине грудной
клетки могут быть связаны с прорастанием опухоли в плевру. При
поражении физиологической кардии у больных отмечается тошнота и
отрыжка. Прорастание опухоли в диафрагмальный нерв вызывает икоту. В
поздних стадиях возникают дисфагия и пищеводная рвота.
Диагностика
рака пищевода
Основным
методом диагностики рака пищевода является рентгенологическое
исследование, которое начинают с обзорной рентгеноскопии грудной и
брюшной полости, где на фоне заднего средостения в косых положениях на
фоне газового пузыря желудка у ряда больных удается видеть тень
опухоли.
После этого исследуют пищевод с помощью водной взвеси сульфата бария. В
начальной стадии рака определяют на одной из стенок пищевода дефект
наполнения, деформацию и неровность контуров слизистой оболочки. В
области расположения опухоли имеется ригидность стенки пищевода. При
циркулярном росте опухоли наступает сужение просвета пищевода, которое
имеет вид извитого и неровного канала. При блюдцеобразных карциномах
определяют овальный дефект наполнения, вытянутый по длиннику пищевода,
с депо бария (изъязвлением). При больших опухолях характерными
рентгенологическими признаками рака являются неровность и изъеденность
контуров пищевода, обрыв складок слизистой оболочки в области
патологического процесса.
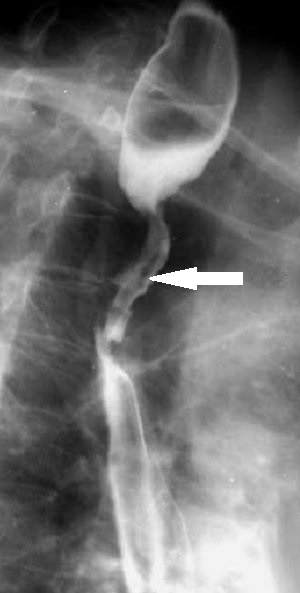
Рентгенологическая
картина рака ретротрахеального сегмента пищевода.
Опухоль циркулярно инфильтрирует стенки пищевода на протяжении около 6
см (стрелка). Просвет пищевода целиком представлен неравномерно
бугристым дном
язвенного кратера. Верхний и нижний контуры пищевода четко очерчены.
Над верхним краем опухоли отмечается кратковременная задержка
контрастной массы.
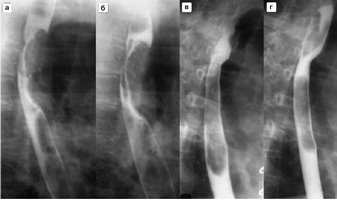
Рентгенологическая
картина рака пищевода с преимущественно внутрипросветным ростом.
Рентгенограмма в условиях двойного контрастирования. а, б - на уровне
I–II и III сегментов просвет пищевода сужен за счет
экзофитной
опухоли, расположенной на передней стенке. Размеры экзофитного
компонента составляют около 7 см. Выше лежащая стенка нависает над
верхним краем опухоли. Задняя стенка пищевода неровная за счет
поверхностного изъязвления. Наблюдается непродолжительная задержка
контрастной массы; в, г – рентгенограммы того же больного
после
лучевой терапии. Отмечается полное исчезновение экзофитного компонента
опухоли. Стенки пищевода ровные. На месте бывшей опухоли определяется
некоторое сужение просвета пищевода. Пассаж контрастной массы свободен.
Важную роль в выявлении начинающейся раковой
инфильтрации играет
рентгенокинематографическое исследование с помощью
электронно-оптического преобразователя. Выше опухоли пищевод несколько
расширен. Перистальтика в этом отделе активная или даже несколько
усилена. В случае длительного стеноза пищевод теряет тонус и
перистальтика почти полностью отсутствует, над сужением отмечают
задержку бариевой взвеси. Для определения распространения опухоли на
соседние органы применяют рентгенологическое исследование в условиях
пневмомедиастинума, делают томограммы в прямой и боковой проекциях.
Рентгенологическое исследование не всегда выявляет ранние стадии рака
пищевода. У некоторых больных опухоль обнаруживают лишь при повторных
исследованиях. Вот почему отсутствие рентгенологических данных при
наличии дисфагии или болей при прохождении пищи не позволяет исключить
рак пищевода.
У всех больных с подозрением на рак пищевода показана
фиброэзофагоскопия. В зависимости от анатомической формы рака вид
опухоли бывает различным. Начальные формы рака могут выглядеть как
нлотный белесоватый бугорок или полип.
При инфильтрирующей форме отмечают местную ригидность стенки пищевода,
выявляемую при надавливании концом эзофагоскопа. При дальнейшем
прогрессировании экзофитной опухоли видна бугристая масса, покрытая
сероватым или кровянистым налетом. Поверхность опухоли легко
кровоточит при прикосновении. Имеется концентрическое или одностороннее
сужение просвета пищевода.
При язвенной форме определяют изъязвившуюся кровоточащую опухоль с
неровными изрытыми краями. Инфильтрирующая форма проявляется
выпячиванием неровной кровоточащей слизистой оболочки, сужением
просвета пищевода.
Эндоскопическая
картина рака пищевода (стрелка).
Биопсия
легко осуществима при экзофитных опухолях, труднее получить для
исследования кусочек ткани при язвенном и инфильтрирующем
раке.
При отрицательном ответе биопсию в сомнительных случаях следует
повторить. При эзофагоскопии необходимо также произвести цитологическое
исследование содержимого пищевода и мазков из области опухоли.
Цитологическое исследование в сочетании с биопсией у большинства
больных позволяет подтвердить или отвергнуть диагноз рака.
Для
выяснения распространенности
опухолевого процесса, поражения лимфатических узлов, выявления
возможных отдаленных метастазов применяется компьютерная, либо
магнитно-резонансная томография.
КТ-признаки рака
пищевода,
вызывающего сужение его просвета
и прорастающего в окружающие органы.
При
подозрении на прорастание опухоли
пищевода в трахею или бронхи выполняется бронхоскопия. Также в плане
комплексного обследования и с целью выявления метастазов показана
обзорная рентгенография органов грудной клетки и средостения, УЗИ
печени, изотопное
исследование костей скелета.
Лечение
рака пищевода
Показания
к операции при раке пищевода
определяются уровнем поражения
органа,
стадией процесса и совокупностью отягчающих обстоятельств (преклонный
возраст, сопутствующие заболевания, низкие функциональные показатели).
Операция выбора - резекция пищевода с опухолью и регионарными
лимфатическими узлами. Однако, чем выше поражён пищевод, тем
возможность её выполнения уменьшается. В этом случае прибегают к
лучевой терапии.
В настоящее время применяются два основных способа оперативных
вмешательств:
* Экстирпация пищевода с пластикой изоперистальтическим желудочным
лоскутом с внеплевральным анастомозом на шее в виде трансплеврального
удаления пищевода или внеплевральной экстирпации - трансхиатальным
доступом. Метод позволяет подвергнуть хирургическому воздействия все
отделы пищевода вплоть до глотки и даже с резекцией ротоглотки.
Нахождение анастомоза на шее вне плевральной полости существенно
снижает риск несостоятельности анастомоза, и она не является фатальной.
В то же время часты случаи рубцового стеноза анастомоза. Следует
подчеркнуть, что трасхиатальный способ (без торакотомии) резекции
пищевода имеет ограниченное применение при опухолях больших размеров. К
сожалению, большинство авторов заявляет о преобладании операций при
распространенных опухолевых процессах.
* Резекция пищевода с одномоментной внутриплевральной
пластикой
пищевода желудком - операция типа Льюиса. Этот способ практически
исключает стенозирование анастомоза, обеспечивает лучшие функциональные
результаты (отсутствие рефлюкс-эзофагита), однако верхние отделы
внутригрудного отдела пищевода остаются недоступными для резекции
(шейный, верхнегрудной отделы).
При выполнении операции при раке пищевода обязательным является
проведение лимфодиссекции как минимум в двух полостях по зонам
лимфогенного метастазирования, а при экстирпации пищевода
лимфодиссекции подвергаются и шейные лимфатические узлы.
Летальность при таких видах операции находится в пределах 7-10 %. В
качестве трансплантата в ряде случаев используют, кроме желудка, тонкую
ил толстую кишку.
Не утратила своего значения операция Торека-Добромыслова в случаях
возможности одномоментного этапа пластики (состояние больного,
технические особенности операции). Следует указать на возможность
выполнения при нерезектабельном раке грудного отдела паллиативных
вмешательств в виде шунтирования опухолевого стеноза наложением
обходного анастомоза.
Ранний
рак пищевода, т.е. опухоли ограниченные
слизистой оболочкой могут удаляться эндоскопической диссекцией в
подслизистом слое, разработанной японскими учёными. Эта операция
заключается в удалении обширной зоны пораженной слизистой
оболочки
с новообразованием и части подслизистого слоя с собственной мышечной
пластинкой слизистой оболочки посредством специальной эндоскопической
техники. Данная методика позволяет полностью удалить опухоль и
прилегающие к ней ткани, избегая большого оперативного вмешательства
(открытой операции). При диссекции пораженная зона с помощью
эндоскопической инъекционной гидропрепаровки поднимается над
подслизистой основой, после чего специальными тонкими инструментами
опухоль удаляется одним блоком с прилегающими тканями.
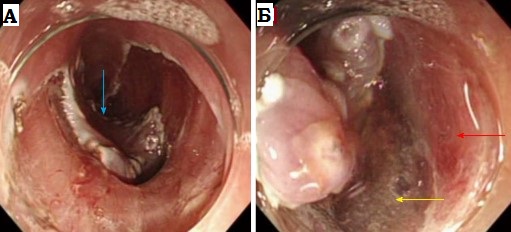
Эндоскопическая
диссекция в подслизистом слое раннего рака пищевода.
А: область поражения раком во время диссекции (синяя стрелка); Б:
собственная мышечная пластинка слизистой оболочки резко закончивается в
области поражения раком.
Красная стрелка указывает на здоровую мышечную
пластинку слизистой оболочки,
желтая - на
область её дефекта.
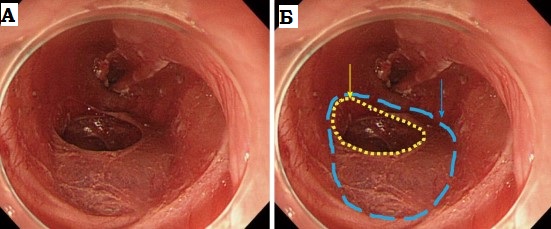
Эндоскопическая
диссекция в подслизистом слое раннего рака пищевода.
Вид после удаления рассечённой ткани. А: язва после эндоскопического
рассечения подслизистого слоя; Б: синяя пунктирная линия указывает на
дефект мышечной
пластинки слизистой
оболочки, желтая пунктирная
линия
указывает на перфорационное отверстие.
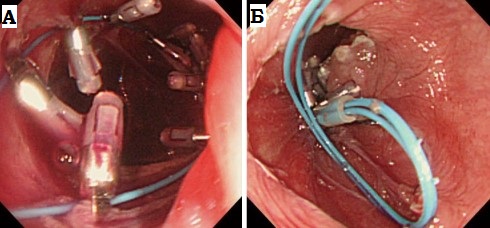
Эндоскопическая
диссекция в подслизистом слое раннего рака пищевода.
Закрытие перфорационного отверстия.
А: дефект мышечной
пластинки слизистой
оболочки;
Б: перфорационное отверстие успешно ушивается.
К
сожалению, больше половины больных раком
пищевода поступает в лечебные учреждения с III–IV стадией
заболевания. Почти 80 % больных составляют лица старше 50 лет,
большинство из которых имеют тяжелые сопутствующие заболевания. В связи
с этим из всех случаев рака пищевода и рака желудка с переходом на
пищевод выполнить резекцию удается менее чем у половины больных. Но и в
случаях резектабельности не все оперативные вмешательства оказываются
радикальными, приводя к излечению больных. По данным отечественной и
зарубежной литературы, показатели операбельности, хотя и существенно
возросли за последние десятилетия, в среднем по прежнему составляют
10–15 %. Даже после радикально выполненной операции у 20 %
больных в дальнейшем развивается дисфагия, обусловленная либо рецидивом
опухоли, либо рубцовой стриктурой анастомоза. Вопросу восстановления
энтерального питания у данной категории больных всегда уделялось
первостепенное значение как на этапах лечения, так и в плане их
последующей со циальной реабилитации. Вследствие этого на первый план
лечения таких пациентов выходят мероприятия, направленные на
восстановление проходимости пищеварительной трубки. К ним относятся:
- формирование
обходного анастомоза или выполнение паллиативной операции;
- периодическое
бужирование стриктуры;
- реканализация
стриктуры путем деструкции опухоли высокоэнергетическим лазерным
излучением;
- установка
в зону
стриктуры стента;
- химиотерапия;
- лучевая
терапия;
- формирование
гастростомы или комбинация различных сочетаний перечисленных
мероприятий.
Гастростомия
по Витцелю.
Данные
литературы свидетельствуют о многообразии малоинвазивных методов
реканализации стриктур пищевода. Необходимость реканализации
продиктована низкой эффективностью лучевого и химиолучевого методов
лечения распространенных опухолевых поражений, невозможностью
осуществления в большинстве случаев радикального хирургического
лечения, необходимостью срочного восстановления энтерального питания,
более высоким риском паллиативных шунтирую щих операций при
сопоставимой с малоинвазивными методиками эффективностью и другими
причинами.
Простейший метод восстановления пассажа пищи по стенозированному
пищеводу – бужирование – неосуществим при полном и
протяженном блоке. В случаях неполного стеноза оно временно улучшает
проходимость пищевода, однако нередко чревато такими осложнениями, как
перфорация стенки пищевода и профузное кровотечение. Эндоскопическое
бужирование с применением направляющей струны существенно уменьшает
вероятность перфорации, однако не избавляет от опасности возникновения
кровотечения из повреждаемой бужами опухоли. К сожалению, эффект
непродолжителен, а риск осложнений высок.
Аналогичен методу бужирования, но менее травматичен способ баллонной
дилатации пищевода, применяемый чаще при рубцово стенотических
осложнениях и обладающий теми же недостатками (не всегда осуществим,
опасность разрыва пищевода, кровотечения, непродолжительность эффекта).
Другую группу составляют методы, в основе которых лежит принцип
разрушения внутрипросветного компонента стенозирующей опухоли
(механическим, электрохирургическим, лазерным и плазменным способами,
методами фотодинамической терапии, радиочастотной абляции). Метод
электрокоагуляционной
реканализации стенозирующих опухолей пищевода позволяет в той или иной
степени восстановить проходимость пищевода. Относительно быстрый
рестеноз после электрохирургической реканализации опухолей, примененной
как самостоятельный метод, опасен возможностью кровотечения из опухоли
в зоне воздействия. Метод, основанный на принципе фотокоагуляции и
испарения опухолевой ткани направленным воздействием
высокоэнергетического лазерного излучения, позволяет реканализировать
протяженные опухолевые стенозы. Однако, несмотря на существенное
превосходство лазерной деструкции стенозирующих опухолей пищевода по
сравнению с другими паллиативными методами, существует ряд сложностей в
реализации планов лазерной реканализации. Главная из них –
невозможность предугадать осевую линию пищевода при полном его стенозе,
когда визуализации доступен лишь проксимальный полюс опухоли. В
сочетании с прямолинейной направленностью вектора лазерного излучения
это лимитирует стремление врача, опасающегося перфорации пищевода,
реканализировать такую опухоль. Радиочастотная абляция - введение в
пищевод катетера с баллоном, содержащим миниатюрные электроды. Когда
баллон надувается, электроды касаются поражённой области пищевода,
подают на неё электрический ток, который воздействует на
злокачественные клетки.
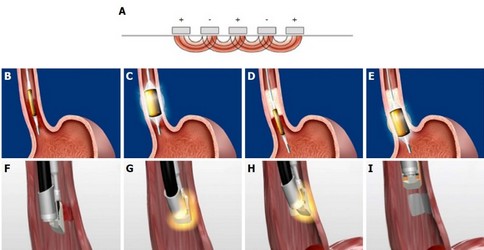
Радиочастотная
абляция рака пищевода - механизм и техника.
Общий недостаток данной группы методов
– быстрый рецидив дисфагии и, следовательно, необходимость
многократного по вторения мероприятий.
Стентирование пищевода – направление отнюдь не новое. Первые
попытки восстановления проходимости пищевода при его обструкции
злокачественной опухолью предпринимались более 100 лет назад с помощью
протезов, изготовленных из слоновой кости и дерева. Такие протезы
доставлялись к стриктуре через рот и фиксировались снаружи (иногда к
усам пациента). Отсутствие возможности визуально контролируемой
установки таких протезов в конечном счете привело к "открытому"
введению в стриктуру труб Celestin, что требовало выполнения лапаро-
и гастротомии. Эти процедуры сопровождались высокой частотой
осложнений и летальности и были негуманны.
Бурное развитие в последнее десятилетие высоких технологий, создание
новых медицинских материалов и технических средств заставило отказаться
от подобного метода восстановления проходимости пищевода у
неоперабельных онкологических больных.
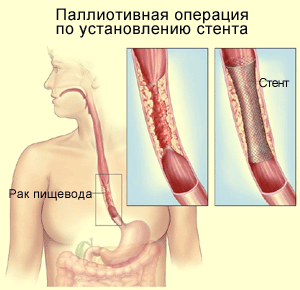 Появление
рентгенологических и эндоскопических методов исследования значительно
обезопасило процедуру установки жестких пищеводных стентов.
Предварительно, за 4–5 дней до установки стента, обязательно
производилось бужирование пищевода на 2–4F размера больше,
чем
диаметр предполагаемого для установки эндопротеза. Однако чрезмерная
жесткость стента, большой внешний и маленький внутренний диаметры
обусловливали возникновение ряда проблем. Частота ранних осложнений
такого стентирования достигала 20 %, частота перфораций –
3–15 %, смертность – 6–10 %. Ранние
осложнения
представляли собой кровотечение, перфорацию пищевода, диспноэ (из за
сдавления трахеи), а также неадекватное расположение протеза; поздние
– миграцию, отсроченные кровотечения, формирование
эзофаготрахеального свища, обструкцию опухолью дистального или
проксимального конца эндопротеза, аспирацию пищевых масс, окклюзию
просвета эндопротеза пищей. Частота ранних и поздних осложнений
составляла 25–40 %. Появление
рентгенологических и эндоскопических методов исследования значительно
обезопасило процедуру установки жестких пищеводных стентов.
Предварительно, за 4–5 дней до установки стента, обязательно
производилось бужирование пищевода на 2–4F размера больше,
чем
диаметр предполагаемого для установки эндопротеза. Однако чрезмерная
жесткость стента, большой внешний и маленький внутренний диаметры
обусловливали возникновение ряда проблем. Частота ранних осложнений
такого стентирования достигала 20 %, частота перфораций –
3–15 %, смертность – 6–10 %. Ранние
осложнения
представляли собой кровотечение, перфорацию пищевода, диспноэ (из за
сдавления трахеи), а также неадекватное расположение протеза; поздние
– миграцию, отсроченные кровотечения, формирование
эзофаготрахеального свища, обструкцию опухолью дистального или
проксимального конца эндопротеза, аспирацию пищевых масс, окклюзию
просвета эндопротеза пищей. Частота ранних и поздних осложнений
составляла 25–40 %.
Для уменьшения частоты таких осложнений начали применять
саморасширяющиеся пищеводные стенты (self expandable stents).
Департамент США по сертификации новых лекарств (FDA) недавно
сертифицировал 4 металлических саморасправляющихся стента для
устранения дисфагии при злокачественных процессах: Gianturco Z stent
(Wilson–Cook, Winston–Salem, NC), Wallstent
(Schneider.
Minneapolis, MN), Ultraflex – сетчатый нитиноловый стент
(Microvasivc, Natick. MA) и EsophaCoil (Instent, Eden Prairie, MN).
Теоретически преимущества саморасширяющихся пищеводных стентов над
обычными жесткими стентами включают их более простую установку в
случаях остроугольных стенозов и более низкий риск кровотечения или
перфорации пищевода во время имплантации; в отличие от жестких
саморасправляющиеся стенты не требуют предварительного расширения
просвета в зоне стриктуры пищевода до 48–51F. Практическое
применение вышеперечисленных моделей стентов, по мнению многих авторов,
позволило улучшить непосредственные и отдаленные результаты
восстановления проходимости пищевода, снизить количество ранних и
поздних осложнений их имплантации, значительно улучшить качество жизни
больных.
Имплантированный
при раке пищевода стент, эндоскопическая картина.
а – проксимальный конец опухолевой стриктуры пищевода
(выраженность дисфагии IV степени), б – восстановленный
сетчатым
нитиноловым стентом просвет пищевода.
Так,
S.M.
Shimi,
изучивший результаты применения с 1983 г. стентов из металлического
сплава, расширяющегося при температуре тела, показал, что они
относительно легко устанавливаются под рентген- или
эндоскопическим контролем, а их установка редко сопровождается ранними
осложнениями. Поздние осложнения, требующие повторного вмешательства,
могли встретиться у трети больных. Возникающие осложнения представляют
собой: боль в грудной клетке, дислокацию стента, некроз опухоли от
давления, гастроэзофагеальный рефлюкс, врастание опухоли внутрь
просвета стента через ячейки сетчатой конструкции. Появление стентов из
никель титанового сплава значительно снизило частоту ранних и поздних
осложнений, требующих выполнения повторных вмешательств.
F.
Spivak et
al. в ретроспективном обзоре данных за 1990–2000 годы
показали
преимущество имплантации стентов перед хирургическим формированием
обходных анастомозов у больных раком пищевода, осложненным бронхо
эзофагеальным свищом (существенное снижение смертности).
А.
Watson,
проанализировав группу больных, перенесших установку стентов за период
более 20 лет, выявил несомненное преимущество саморасширяющихся
металлических стентов по сравнению с пластмассовыми эндопротезами,
отметив при этом в качестве недостатков сетчатых стентов их высокую
стоимость и необходимость повторного вмешательства из-за врастания
внутрь опухоли при установке "непокрытых" стентов.
N.
Davies
et al. представили результаты наблюдений за 87 больными неоперабельным
раком пищевода, которым было выполнено стентирование опухолевых
стриктур пищевода: в 46 случаях из 87 были установлены трубы Аtkinson
(в период с 1990 по 1994 г.), в 41 – нитиноловые стенты
(после
1994 г.). Осложнения наблюдались в обеих подгруппах: 56 % после
установки стентов-труб Аtkinson и 44 % – нитиноловых стентов.
Перфорация пищевода стентами-трубами Аtkinson отмечена у 8 больных (17
%), нитиноловыми стентами – у 1 (2,4 %). Авторы утверждают,
что
использование нитиноловых стентов для снижения выраженности дисфагии у
больных с неоперабельным раком пищевода имеет значительное преимущество
перед введением труб Atkinson.
A.
Guitron
et al. приводят результаты собственных исследований у 12 больных (6
мужчин и 6 женщин, средний возраст 58 лет) с дисфагией, вызванной
опухолевым поражением пищевода (в 6 случаях опухоли поражали область
желудочно-пищеводного перехода, в 4 – дистальную, в 2
–
среднюю треть пищевода), которым было выполнено стентирование
опухолевой стриктуры. До установки стента выраженность дисфагии у
больных расценивалась как соответствующая III степени.
Стентирование оказалось успешным в 91,6 % и сопровождалось снижением
выраженности дисфагии до уровня I степени, а достигнутый эффект
сохранялся в среднем 10,5 нед. Ранние осложнения были представлены
болью за грудиной, отмечав шейся у 2 больных, которая постепенно, в
течение нескольких дней, исчезла.
Отмечено, что более частые осложнения возникают при использовании
латексных протезов (47 %), чем металлических стентов (16 %); рецидивы
дисфагии, связанные с прорастанием опухоли внутрь эндопротеза, были
отмечены в 26 % случаев использования латексных протезов и в 24 %
– металлических стентов. Предшествующая лучевая и (или)
химиотерапия увеличивала частоту осложнений от латексных протезов (у 12
из 28 – 43 %) против 17 % (у 8 из 47) при применении
металлических стентов. Также отмечалось более длительное пребывание
больных в стационаре при использовании латексных протезов (6,3
±
5,2 дня против 4,3 ± 2,3 дня).
При детальном изучении 81 случая имплантации стентов отмечено, что у 49
пациентов (60 %) возникла различного генеза обструкция установленных
стентов, сопровождавшаяся возобновлением дисфагии различной степени
выраженности: у 26 из 49 больных (53 %) причиной было прогрессирование
опухоли, у 23 (47 %) установлены иные причины, не связанные с
опухолевой обструкцией просвета стента.
F.
Mosca
et al. сообщают о результатах применения стентов у 21 больного.
Осложнения были отмечены у 9 больных (42,8 %): кровотечения –
у
2, опухолевая обструкция стента – у 3, обструкция стента
пищевыми
массами – у 1, у 3 – своевременно устраненное
дистальное
смещение эндопротеза. Случаев смерти отмечено не было. Медиана
выживаемости составила 151 день (диапазон 25–545 дней).
Y.
Funami
et al. сообщают, что у 12 больных с неоперабельным раком пищевода после
проведения лучевой и химиотерапии была произведена установка
нитинолового стента в зону опухолевой стриктуры пищевода. Исходная (до
начала лечения) дисфагия была различной степени выраженности,
оценивалась следующим образом: I степень – сохраненная
возможность принимать "негрубые" пищевые продукты; II степень
–
способность принимать лишь жидкую пищу, необходимость дополнительного
парентерального питания; III степень – невозможность
принимать
какую-либо пищу. После лучевой терапии и химиотерапии количество
больных в 1-й группе увеличились от 3 до 5, у 7 больных выраженность
дисфагии соответствовала II–III степени. У 4 больных со
II–III степенью дисфагии были установлены стенты, после этого
выраженность дисфагии уменьшилась и оценивалась как соответствующая I
степени. У больных с I степенью дисфагии, сохранившейся после
лучевой и химиотерапии, подобная выраженность дисфагии без
установки стентов удерживалась в среднем до 167 дней, а средняя
выживаемость со ставила 191 день. У больных с внедренным в зону
стриктуры стентом остаточная дисфагия I степени удерживалась в среднем
до 65 дней, а продолжительность жизни от момента установки стента со
ставила в среднем 149 дней. В группе больных со II степенью
выраженности дисфагии, не подвергавшихся стентированию, выживаемость
составила, в среднем, 91 день. После введения нитиноловых стентов все
больные могли самостоятельно питаться.
Несмотря на высокую стоимость нитиноловых стентов (в пределах
1000–1800$) и десятикратное различие в цене между
саморасширяющимися и обычными протезами, недавние исследования по
казали, что в лечении злокачественных стриктур пищевода
саморасширяющиеся металлические стенты экономически выгоднее и
безопаснее, чем жесткие пластиковые протезы.
Большинство авторов утверждает, что имплантация саморасширяющихся
нитиноловых стентов с целью ликвидации дисфагии, обусловленной
злокачественной опухолью, – безопасная и высокоэффективная
манипуляция, которая у больных с установленным сочетанием опухолевой
обструкции пищевода со "злокачественной" респираторно-пищеводной
фистулой может рассматриваться как лечебная процедура.
Лучевое
лечение
рака пищевода остается единственным методом лечения для
большинства больных, которым оперативное лечение противопоказано ввиду
имеющейся у них сопутствующей патологии (выраженные расстройства
сердечно-сосудистой, дыхательной систем и др.), при преклонном возрасте
больных, отказе больных от операции. В ряде случаев лучевое
лечение
носит изначально паллиативной характер (после проведенной ранее
лапаротомии и гастростомии).
Применение современных методик облучения позволяет добиться
исчезновения тягостных клинических проявлений заболевания у 35-40 %
больных.
Целью облучения является создание в области облучаемого органа
терапевтической дозы в 60-70 Гр. Одновременно, кроме пораженного
органа, в область облучения должны включаться зоны расположения
лимфатических узлов, зона возможного метастазирования:
параэзофагеальные лимфатические узлы, зона лимфатических узлов
паракардиальных, области левой желудочной артерии и чревного ствола,
надключичных областей. Классическим методом облучения является 5
сеансов лучевой терапии в неделю в разовой очаговой дозе 1,5-2 Гр
(классическое фракционирование дозы). При других вариантах
фракционирования дозы, подводимые в течение дня, могут меняться, как
могут меняться и разовые очаговые дозы.
Весьма эффективными при раке пищевода оказались методы внутриполостного
облучения. Внутриполостная лучевая терапия выполняется на аппарате АГАТ
ВУ. При этом тонкий зонд с радиоактивным кобальтом вводится в просвет
пищевода и устанавливается на уровне поражения. Источники излучения
устанавливают на 1 см ниже и выше определяемых границ опухоли. Наиболее
благоприятным следует считать сочетание дистанционного облучения с
внутриполостным.
Комбинированное
и
комплексное лечение.
Стремление онкологов улучшить отдаленные
результаты лечения послужило поводом к разработке и применению
комбинированного метода, сочетающего лучевую терапию и операцию.
Наиболее оправданно применение комбинированного лечения у больных с
локализацией опухоли в среднегрудном отделе пищевода.
Доказано, что предоперационная лучевая терапия оказывает
бластостатическии эффект, расширяет резектабельность, приводит к
уменьшению количества местных рецидивов.
В качестве компонента комбинированного лечения лучевая терапия
позволяет расширить показания к радикальному лечению
местно-распространенных опухолей пищевода, повысить радикальность
операций, снизить частоту местных рецидивов и метастазов.
Предоперационная лучевая терапия проводится в различных вариантах.
Применение методики укрупненного фракционирования дозы интенсивным
ритмом по 4 Гр 5-6 раз в неделю до СОД 20-24 Гр оправдано при малой
протяженности опухоли, при отсутствии глубокого изъязвления опухоли,
при дисфагии I-II степени и отсутствии выраженных нарушений со стороны
сердечно-сосудистой и дыхательной систем.
При большей протяженности опухоли более оправданно применение методики
классического фракционирования по 2 Гр 5раз в неделю до СОД 40-45 Гр
или схемы динамического фракционирования дозы - по 4 Гр 3 дня, затем по
2 Гр ежедневно до СОД 36-42 Гр. Оптимальный интервал между окончанием
лучевой терапии и операцией при методике укрупненного фракционирования
дозы - 5-7 дней, а при методике классического и динамического
фракционирования 2-3 недели. Лучевая терапия в традиционном варианте
комбинированного лечения используется перед операцией, однако в
клинической практике возникают такие ситуации, когда проведение лучевой
терапии до операции осуществлено либо из-за высокого риска развития
осложнений, связанных с распадом. В этих случаях целесообразно
использовать послеоперационное облучение.
В случаях, когда клетки опухоли вышли за пределы ее видимых границ или
остались в ее ложе, сохранив биологическую активность, целесообразно
использование химиотерапии. Химиотерапия применяется при
низкодифференцированных формах рака пищевода и при мелкоклеточном раке
пищевода.
Лучевое и химиотерапевтическое лечение необходимо проводить на фоне
терапии, направленной на предупреждение и купирование возможных
нарушений эритро- и лейкопоэза, иммунодепрессии (переливание препаратов
крови, иммуностимуляция, инфузионная терапия, витаминотерапия).
Пятилетняя выживаемость больных после комбинированного лечения
достигает 56,6% при радикальном характере оперативных вмешательств и
7,0 % после паллиативных. При комплексном лечении после паллиативных
операций выживаемость достигает 30,8 %.
Рак пищевода в большинстве случаев является относительно медленно
прогрессирующим заболеванием. По степени злокачественности он находится
между самыми злокачественно текущими заболеваниями и теми, которые
достаточно доброкачественны. Нелеченный рак имеет плохой прогноз.
Средняя продолжительность жизни таких больных не превышает 5-8 месяцев
с момента появления признаков болезни. Правда, при ранней диагностике
зарегистрированы случаи продолжительности жизни до 6 лет без
какого-либо лечения.
Прогноз заболевания при лучевой терапии зависит от формы роста опухоли.
Наихудшими являются результаты при эндофитной форме роста опухоли.
Трехлетние результаты при этой форме роста составляют 6 %, тогда как
при экзофитной форме - 27 %.
Применение лучевой терапии по паллиативной программе дает возможность
7-10 % больных прожить более года. Повышение эффективности лучевого
лечения связывается с совершенствованием методик облучения, увеличением
чувствительности опухоли к облучению за счет использования
радиосенсибилизирующих препаратов и сочетанием с химиотерапией и
иммуностимулирующими воздействиями.
Продолжительность жизни после радикальных операций по поводу рака
пищевода является основным и наиболее важным показателем эффективности
хирургического и комбинированного лечения. При хирургическом лечении,
среди перенесших радикальные операции, 5-летний срок выживания зависит
от различных обстоятельств. Основным является распространенность
опухолевого процесса. При малых размерах Т1 опухоли 5-летняя
выживаемость составляет 46,9 %, при Т2 - 42,9 %, при Т3 - 33,7 %, при
Т4 – 25 %. Наличие метастазов в лимфатические узлы является
неблагоприятным фактором и значительно уменьшает срок 5-летней
выживаемости (вдвое). При III стадии процесса комбинированное лечение
(предоперационная лучевая терапия и операция) позволяет увеличить сроки
5-летней выживаемости с 10,5 до 25,4 %.
|
|
|

